Углеводы

Классификация углеводов
Моносахариды
Дисахариды
Растительные полисахариды
Значение в питании моносахаров, дисахаридов и растительных полисахаридов
Животные полисахариды
Понятие о метаболизме
Пути метаболизма
Цикл лимонной кислоты
Гликолиз
Метаболизм гликогена
Количество углеводов, рекомендуемое для приема
Роль углеводов в организме
Динамика углеводов при упражнениях
Моносахариды
Дисахариды
Растительные полисахариды
Значение в питании моносахаров, дисахаридов и растительных полисахаридов
Животные полисахариды
Понятие о метаболизме
Пути метаболизма
Цикл лимонной кислоты
Гликолиз
Метаболизм гликогена
Количество углеводов, рекомендуемое для приема
Роль углеводов в организме
Динамика углеводов при упражнениях
Классификация углеводов
Углеводы — это полиатомные альдегидо- или кетоспирты, которые подразделяются в зависимости от количества мономеров на моно-, олиго- и полисахариды.
1) Моносахариды - это сахара, которые не могут гидролизироваться на более простые углеводы. Они могут классифицироваться на триозы, тетрозы, пентозы, гексозы или гептозы, в зависимости от количества атомов угерода (3-7) и альдозы или кетозы, в зависимости от того, имеется у них альдегидная или кетонная группа. К альдегидам и кетонам, выделяют еще многоатомные спирты (сахарные алкоголи или полиолы), в которых альдегидная и кетонная группа замещена на алкогольную, встречается в натуральных продуктах.
- глюкоза - С6Н12О6;
- фруктоза (леволоза) - превращается в глюкозу в печени;
- галактоза - не существует свободно в природе, обычно она соединена с глюкозой, формируя молочный сахар. В организме галактоза переводится в глюкозу.
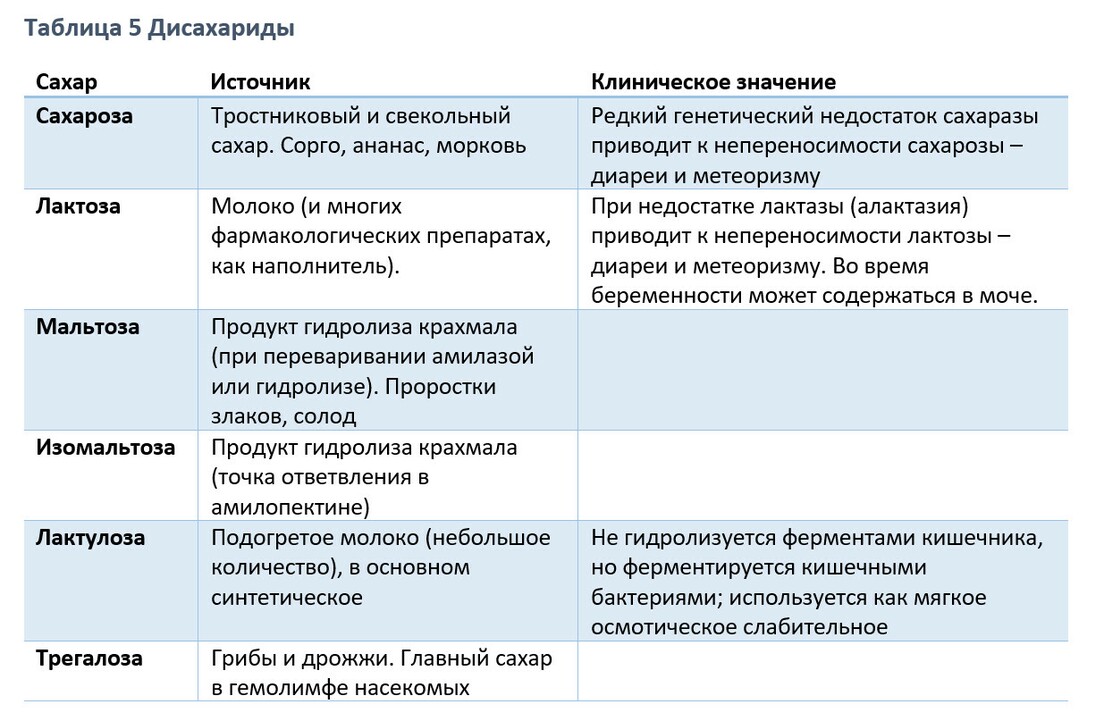
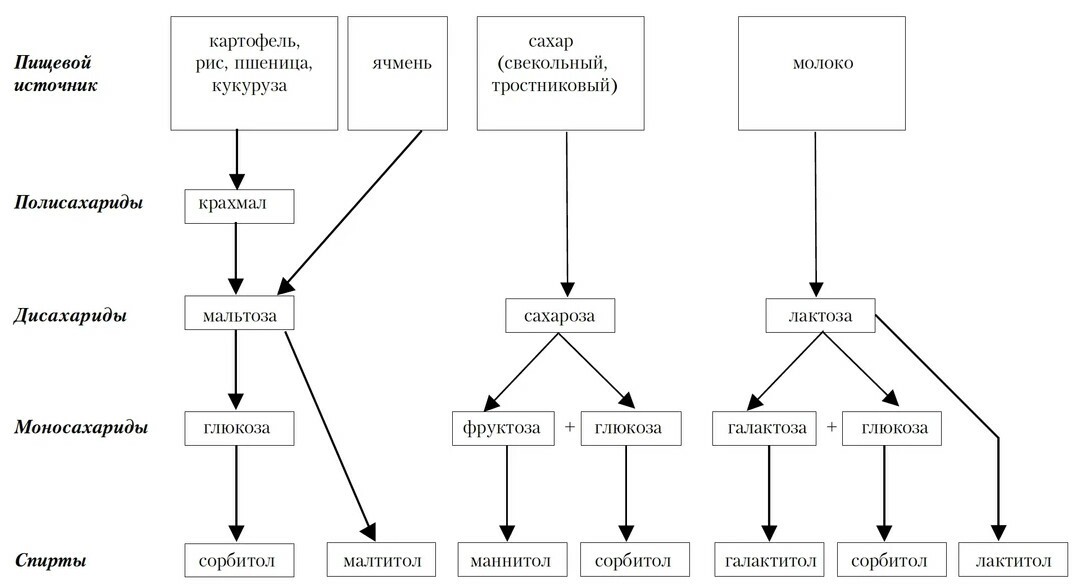
2) Дисахариды - продукты контенсации из двух моносахаридных единиц, например, лактоза, мальтоза, изомальтоза, сахароза и трегалоза; (моносохариды и дисахариды - простые сахара). Все дисахариды содержат глюкозу.
-- сахароза (глюкоза + фруктоза) - наиболее частый диетический дисахарид (свекольный, тростниковый сахар, коричневый сахар, сорго, кленовый сироп, мед);
-- лактоза (глюкоза + галактоза) - не обнаружена в растениях, встречается только в молоке животных;
-- мальтоза (глюкоза + глюкоза) - встречается в пиве, зерновых хлопьях, пророщенных семенах. Мальтоза называется также солодовым сахаром- промежуточный продукт расщепления крахмала пищеварительными ферментами и ферментами пропросшего зерна (солода).
3) Олигосахариды - продукты конденсации от 3 до 10 моносахаридов, соединенных вместе. Большинство перевариваются человеческими ферментами.
4) Полисахариды - продукты конденсации более, чем 10 моносахаридных единиц; например крахмалы и декстрины, которые могут быть линеными и разветвленными полимерами.
Полисахаридами называют цепочку состояющую от трех до тысячи сахарных молекул. Полисахариды во время химического процесса, называемого дегидрационный синтез, проходящего с потерей воды, формируются более сложные углеводные молекулы. И растительные и животные источники вносят свой вклад эту большую группу цепочек состоящих из моносахаридов.
1) Моносахариды - это сахара, которые не могут гидролизироваться на более простые углеводы. Они могут классифицироваться на триозы, тетрозы, пентозы, гексозы или гептозы, в зависимости от количества атомов угерода (3-7) и альдозы или кетозы, в зависимости от того, имеется у них альдегидная или кетонная группа. К альдегидам и кетонам, выделяют еще многоатомные спирты (сахарные алкоголи или полиолы), в которых альдегидная и кетонная группа замещена на алкогольную, встречается в натуральных продуктах.
- глюкоза - С6Н12О6;
- фруктоза (леволоза) - превращается в глюкозу в печени;
- галактоза - не существует свободно в природе, обычно она соединена с глюкозой, формируя молочный сахар. В организме галактоза переводится в глюкозу.
2) Дисахариды - продукты контенсации из двух моносахаридных единиц, например, лактоза, мальтоза, изомальтоза, сахароза и трегалоза; (моносохариды и дисахариды - простые сахара). Все дисахариды содержат глюкозу.
-- сахароза (глюкоза + фруктоза) - наиболее частый диетический дисахарид (свекольный, тростниковый сахар, коричневый сахар, сорго, кленовый сироп, мед);
-- лактоза (глюкоза + галактоза) - не обнаружена в растениях, встречается только в молоке животных;
-- мальтоза (глюкоза + глюкоза) - встречается в пиве, зерновых хлопьях, пророщенных семенах. Мальтоза называется также солодовым сахаром- промежуточный продукт расщепления крахмала пищеварительными ферментами и ферментами пропросшего зерна (солода).
3) Олигосахариды - продукты конденсации от 3 до 10 моносахаридов, соединенных вместе. Большинство перевариваются человеческими ферментами.
4) Полисахариды - продукты конденсации более, чем 10 моносахаридных единиц; например крахмалы и декстрины, которые могут быть линеными и разветвленными полимерами.
Полисахаридами называют цепочку состояющую от трех до тысячи сахарных молекул. Полисахариды во время химического процесса, называемого дегидрационный синтез, проходящего с потерей воды, формируются более сложные углеводные молекулы. И растительные и животные источники вносят свой вклад эту большую группу цепочек состоящих из моносахаридов.
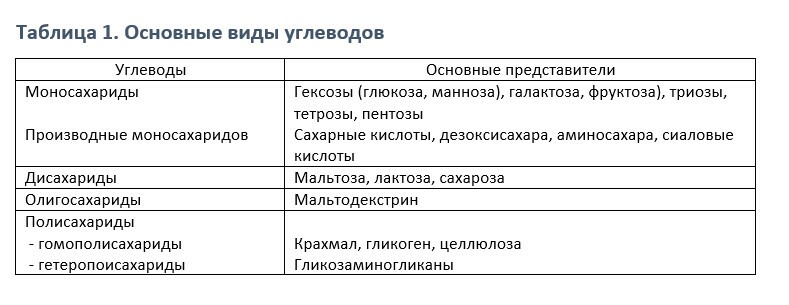

Моносахариды
Структура глюкозы
Линейная структурная формула глюкозы (альдодекстоза). может объяснить некоторые ее свойства, но циклическая структура - термодинамически предпочтительнее, так как учитывает все свойства. Циклическая формула, на рисунке снизу из проекта Хэворт, изображает молекулы сбоку и сверху в кольце; связи, самые близкие к смотрящему утолщены. Атомы водрода, прикрепленные к каждому углероду не изобразаются в этой фигуре. Кольцо, на самом деле, имеет форму кресла.
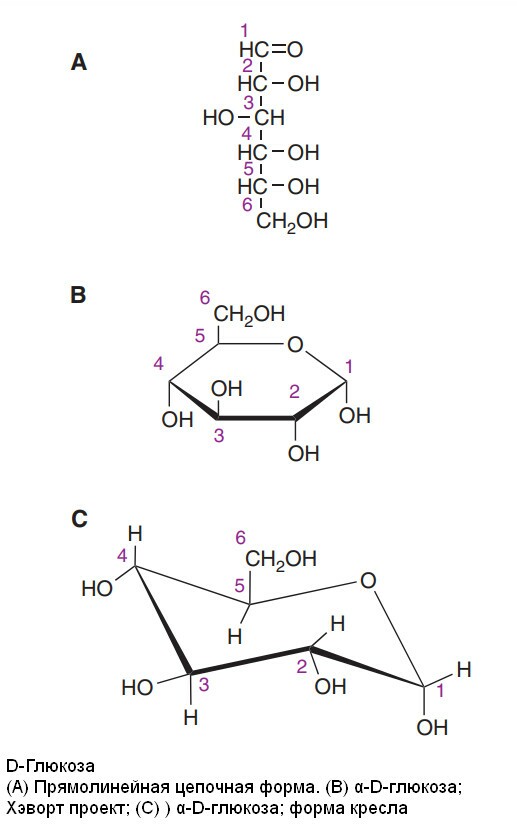
Изомерия сахаров
Соединения, имеющие одну и тоу же структурную формулу, но различающиеся по пространственной конфигурации, называются стереоизомерами. Глюкоза с 4 ассиметричными атомами углерода может формировать 16 изомеров.
1. D и L изомеры. Являются зеркальными оторажениями. Принадлежность к D- или L-ряду определяется ориентацией групп -H и -OH при атоме углерода, соседнем с концевым атомом углерода, содержащим первичную спиртовую группу (5 углерод в глюкозе). Если -ОН группа расположена справа, сахар принадлежит D-изомеру, если слева - то это L-изомер. Большинство моносахаридов в организме имеют D-конфигурацию.
1. D и L изомеры. Являются зеркальными оторажениями. Принадлежность к D- или L-ряду определяется ориентацией групп -H и -OH при атоме углерода, соседнем с концевым атомом углерода, содержащим первичную спиртовую группу (5 углерод в глюкозе). Если -ОН группа расположена справа, сахар принадлежит D-изомеру, если слева - то это L-изомер. Большинство моносахаридов в организме имеют D-конфигурацию.
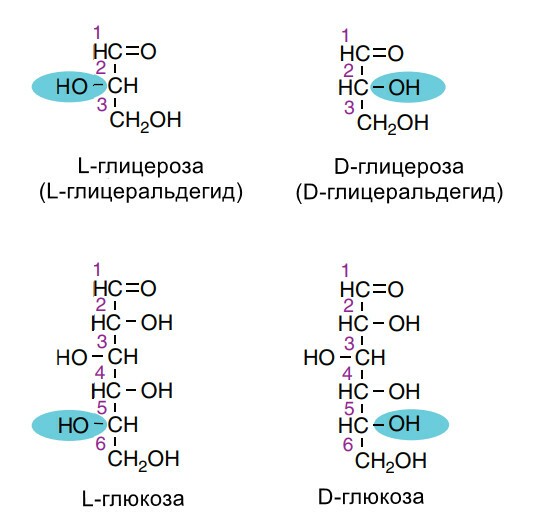
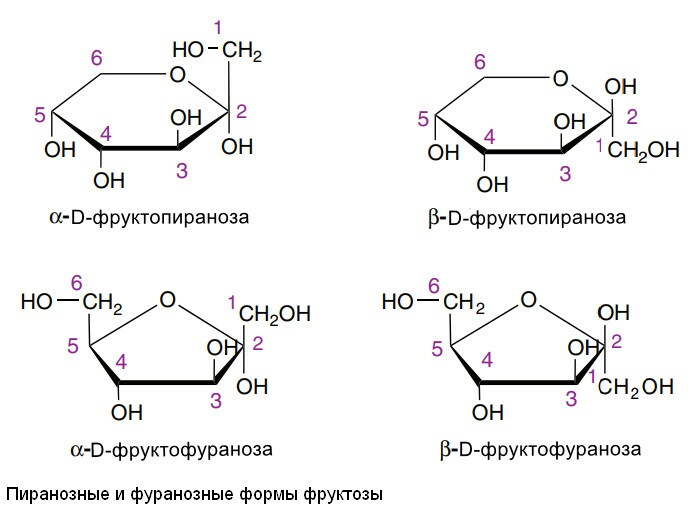
2. Пиранозные и фуранозные кольцевые структуры. Эта терминология основана на существовании устойчивых кольцевых структур моносахаридов, сходных со структурами пирана или фурана. Для глюкозы 99% молекул находятся в пиранозной форме и менее 1% - в фуранозной форме.
3. Альфа- и бета-аномеры. Кристаллическая глюкоза α-D-глюкопиранозная. Циклическая структура сохраняется в растворе, но изомерия происходит на 1 атоме углерода, которое занимает карбонильный или аномерный атом углерода, что приводит к образованию смеси из альфа-глюкопиранозы (38%) и бета-глюкопиранозы (62%). Менее 0.3% представлены альфа- и бета- аномерами глюкофуранозы.
3. Альфа- и бета-аномеры. Кристаллическая глюкоза α-D-глюкопиранозная. Циклическая структура сохраняется в растворе, но изомерия происходит на 1 атоме углерода, которое занимает карбонильный или аномерный атом углерода, что приводит к образованию смеси из альфа-глюкопиранозы (38%) и бета-глюкопиранозы (62%). Менее 0.3% представлены альфа- и бета- аномерами глюкофуранозы.
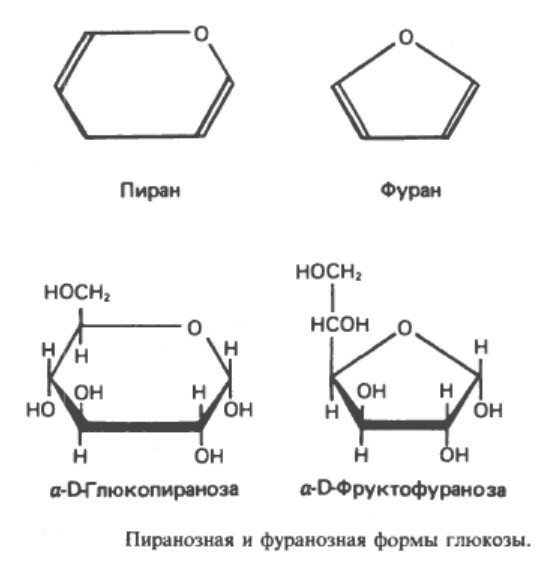
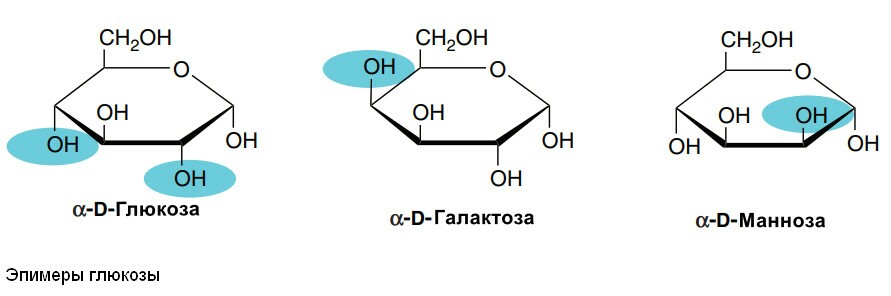
4. Эпимеры. Изомеры, различающиеся по конфигурации положением групп -Н или -ОН при 2, 3 или 4 атомах углерода, называются эпимерами. Биологически наиболее важными эпимерами глюкозы являются манноза и галактоза, образующиеся путем эпимеризации при атомах углерода 2 и 4 соответственно.
5. Альдо-кето-изомеризация. Фруктоза имеет ту же химическую форму, что и глюкоза, но отличается по структурной формуле, фруктоза содержит потенциальную кетонную группу в положении 2, а глюкоза - потенциальную альдегидную группу в положении 1.
Биологически важные кетозы и альдозы изображены на рисунках снизу.
Биологически важные кетозы и альдозы изображены на рисунках снизу.
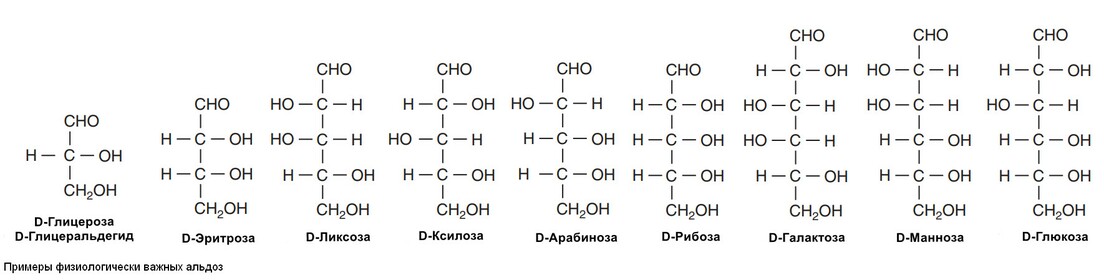
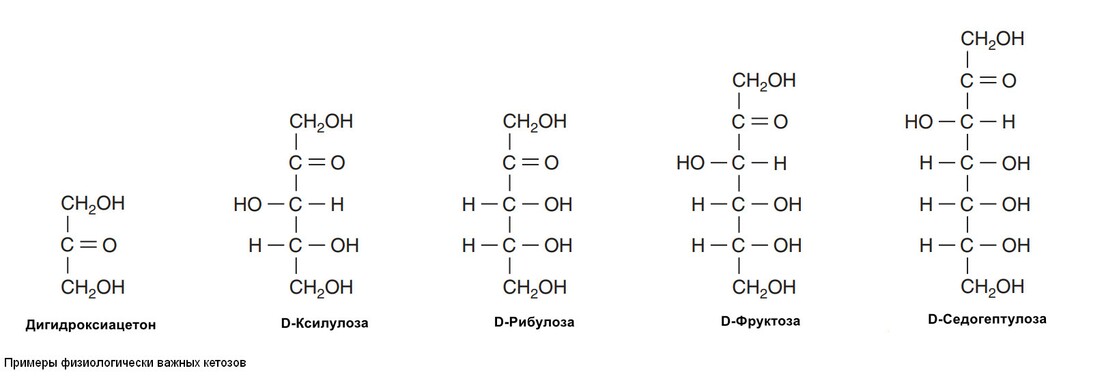
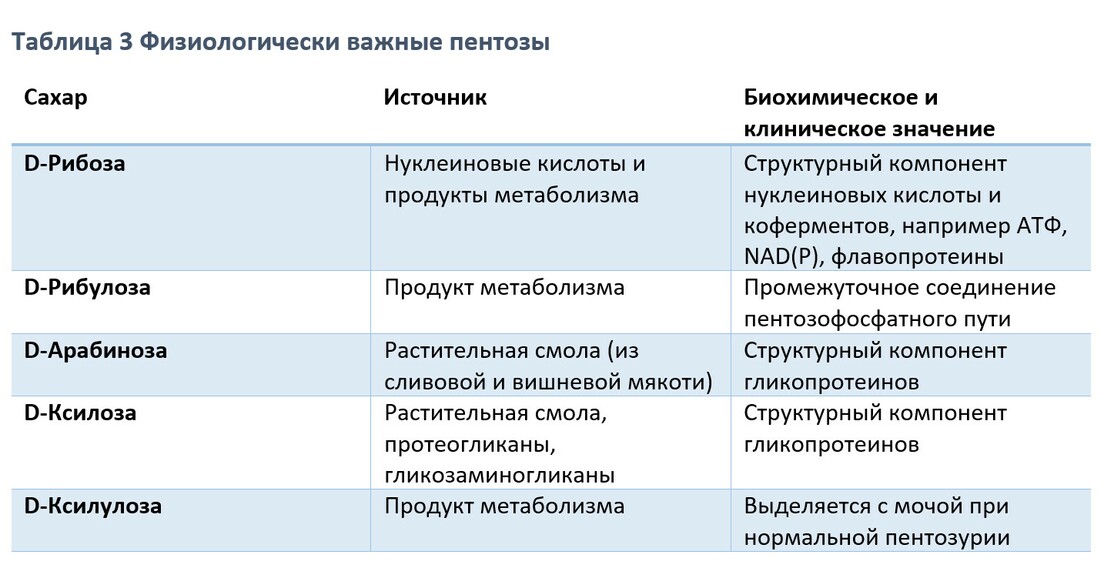
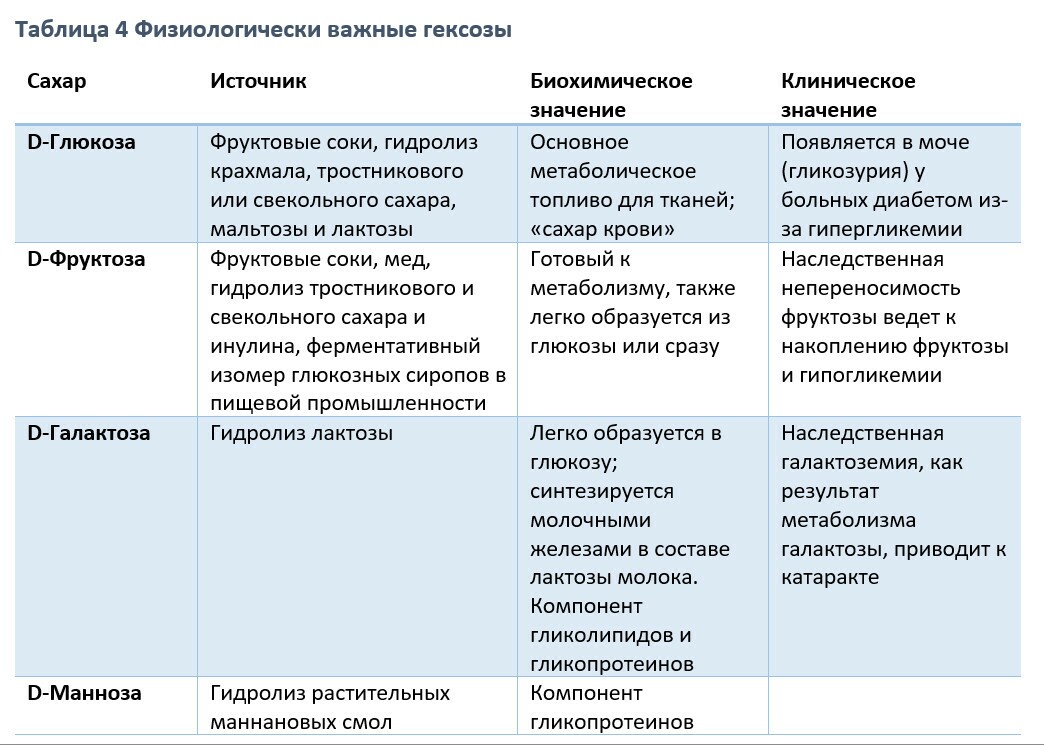
Физиологически важные моносохариды
Метаболические превращения глюкозы по пентозофосфатному пути приводят к образованию приозводных триоз, тетроз и пентоз, а также к образованию семиугольного сахара седогептулозы. Пятиугольные моносахариды, пентозы, являются важными компонентами нуклеотидов, нуклеиновых кислот и многих коферментов. Из гексоз наиболее важное физиологическое значение имеют глюкоза, галактоза, фруктоза и манноза.
Сахара из гликозидов с другими компонентами и друг с другом
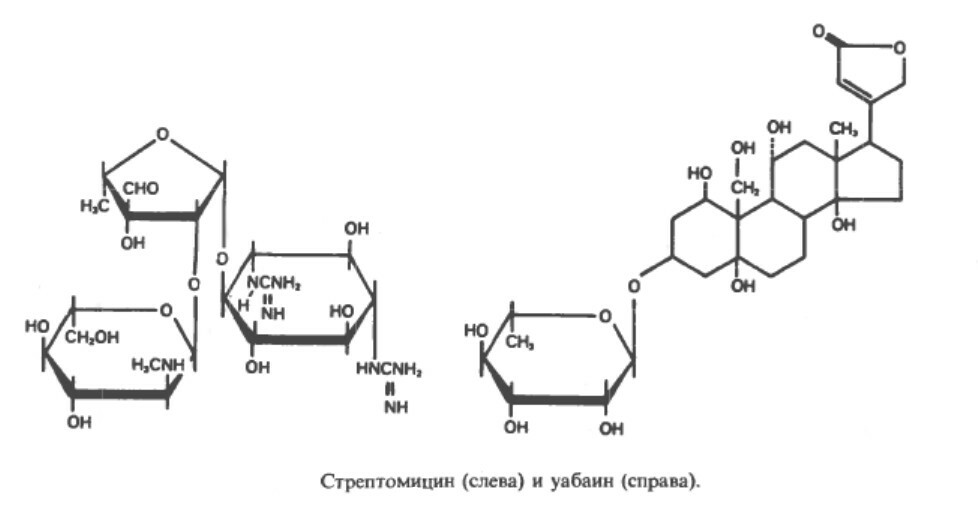
Гликозиды - это соединения, образующиеся путем конденсации моносахарида с гидроксильной группой другого соединения, которым может быть другой моносахарид или вещество углеводной природы (тогда его называют агликоном). Гликозидную связь называют ацетальной. Если полуацетальная группа принадлежит глюкозе, образовавшееся соединение называют - глюкозидом, если галактозе - галактозидом и т.д.
Гликозиды широко распространены в природе. Гликозиды, имеющие важное значение, а именно влияющие на работу серцда (сердечные гликозиды), содержат в качестве агликанового компонента стероиды; так из наперстянки и строфантина выделен гликозид уабаин - ингибитор калий-натриевой-АТФазы клеточных мембран. К числу гликозидов относится ряд антибиотиков, в частности стрептомицин.
Гликозиды широко распространены в природе. Гликозиды, имеющие важное значение, а именно влияющие на работу серцда (сердечные гликозиды), содержат в качестве агликанового компонента стероиды; так из наперстянки и строфантина выделен гликозид уабаин - ингибитор калий-натриевой-АТФазы клеточных мембран. К числу гликозидов относится ряд антибиотиков, в частности стрептомицин.
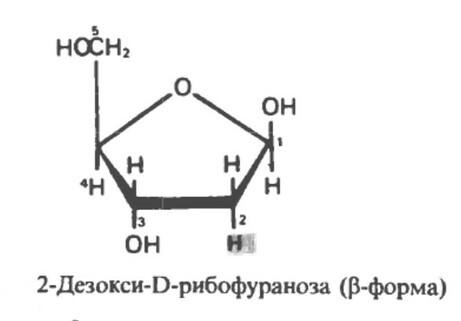
Дезоксисахара
Дезоксисахара - это сахара, у которых гидроксильная группа замещена атомом водорода (нет кислорода). Например, дезоксирибоза, входящая в состав нуклеиновых кислот.
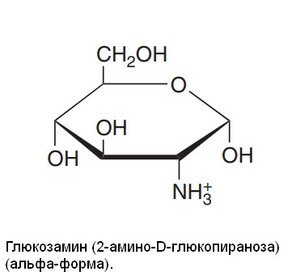
Аминосахара (гексозамины) - компоненты гликопротеинов, ганглиозиды и гликозаминогликаны
Примером аминосахаров служит D-глюкозамин, компонент гиалуроновой кислоты, D-галактозамин (известный также, как хондрозамин), компонент хондроитина, и D-маннозамин. Несколько антибиотиков (например, эритромицин) содержат аминосахара, которые важны в их антибактериальной активности.
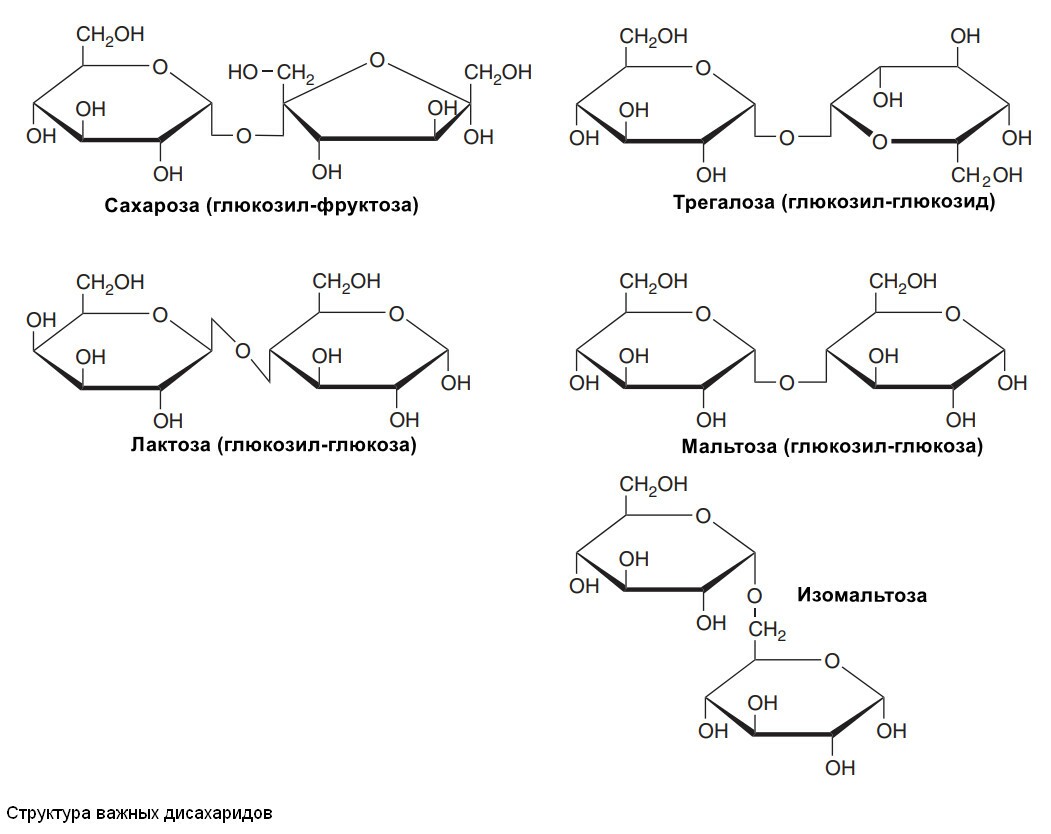
Дисахариды
Дисахариды - сахара, состоящие из двух моносахаридных остатков, соединенных гликозидной связью.
Мальтоза, сукроза и лактоза - важные дисахариды
Физиологически важными дисахаридами являются мальтоза, сахароза, лактоза и трегалоза. Гидролиз сахарозы приводит к образованию смеси глюкозы и фруктозы, называемой "инвертированные сахара", так как вней преобладает левовращающая (инвертирующая) фруктоза.
Растительные полисахариды
Крахмал – моносахаридные остатки соединены в крахмале альфа-глюкозидными связями. Соединение, образованное только остатками глюкозы, является гомополимером, его называют глюкозаном или глюканом. Это наиболее важный вид пищевых углеводов; он содержится в злаках, картофеле, бобовых и в других растениях. Двумя главными компонентами крахмала являются амилоза (13-20%), и амилопектин (80-87%).
Термином «сложный углевод» описывают пищевой крахмал, который представляет наиболее важный источник углеводов и достигает 50% пищевого рациона.
- Амилоза – прямая длинная неразветвленная спиральная цепь;
- Амилопектин – сильно разветвленная цепь из моносахаридов.
Термином «сложный углевод» описывают пищевой крахмал, который представляет наиболее важный источник углеводов и достигает 50% пищевого рациона.
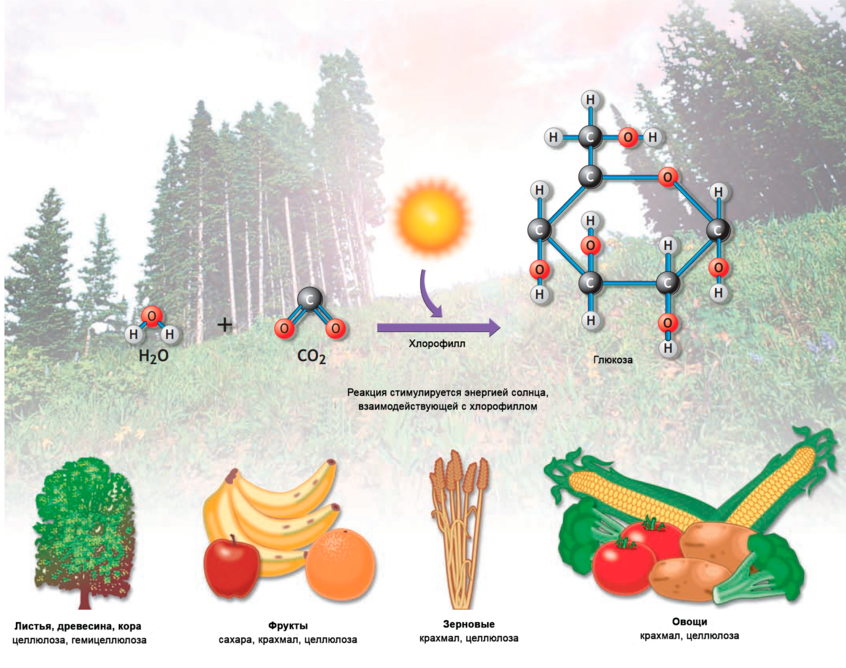
Рис1: Трехмерная кольцевая структура молекулы глюкозы формируется во время фотосинтеза из энергии солнца, взаимодействующей с водой, углекислым газом и зеленым пигментом растений хлорофиллом. Формула глюкозы (С6Н12О6).
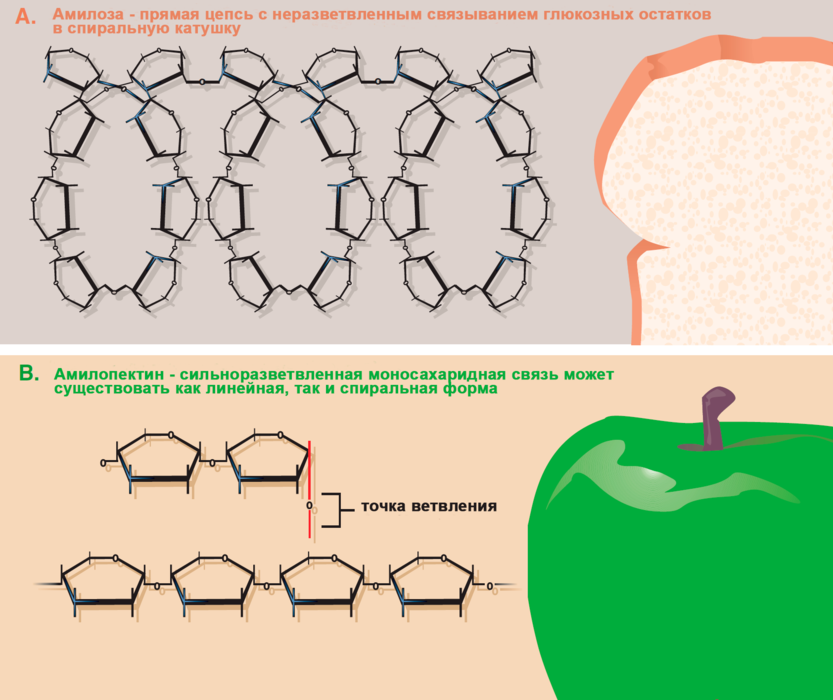
Рис2: Две формы растительного крахмала. А. Прямая цепочка в амилозном крахмале организована в спиральный виток. Амилоза - прямая цепь с неразветвленным связыванием глюкозных остатоков (гликозидная связь). Б. Точка ветвления в высокоразветвленной амилопектиновой крахмальной молекуле. Стурктура амилопектина является линейной, но существует также и в спиральной форме
Волокна (клетчатка) определяются как структурный полисахарид, включающий целлюлозу – наиболее распространенная органическая молекула на земле. Волокна не перевариваются у человека, хотя небольшие порции ферментируются под действием бактерий толстого кишечника и участвуют метаболических реакциях последующей кишечной всасываемости. Клетчатка встречается только у растений, и является структурой листьев, стволов, корней, семян и оболочек фруктов и овощей.
Инулин - полисахарид, содержащийся в клубнях и корнях георгинов, артишоков и одуванчиков. При его гидролизе образуется фруктоза, следовательно он представляет собой фруктозан. Этот полисахарид в отличие от картофельного крахмала легко растворяется в теплой воде.
Декстринами называются вещества, образующиеся при гидролизе крахмала.
Инулин - полисахарид, содержащийся в клубнях и корнях георгинов, артишоков и одуванчиков. При его гидролизе образуется фруктоза, следовательно он представляет собой фруктозан. Этот полисахарид в отличие от картофельного крахмала легко растворяется в теплой воде.
Декстринами называются вещества, образующиеся при гидролизе крахмала.
Значение в питании моносахаров, дисахаридов и растительных полисахаридов
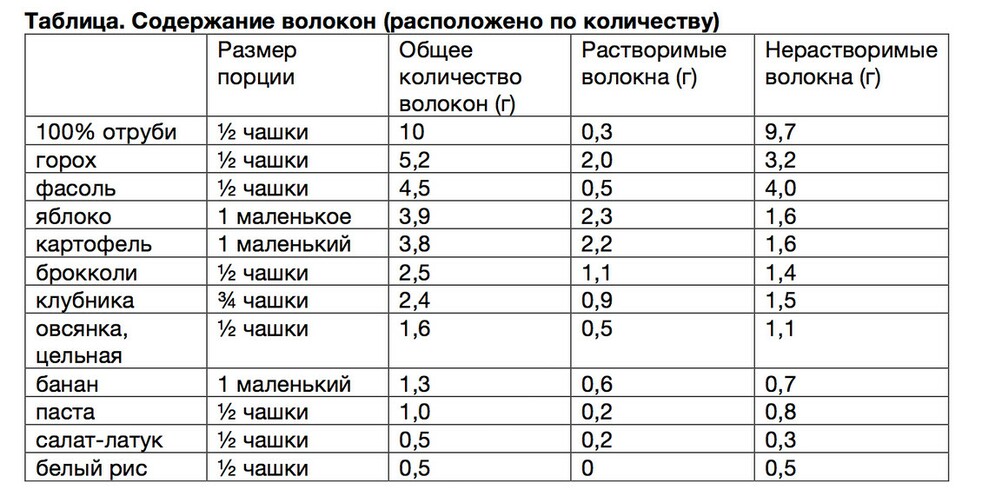
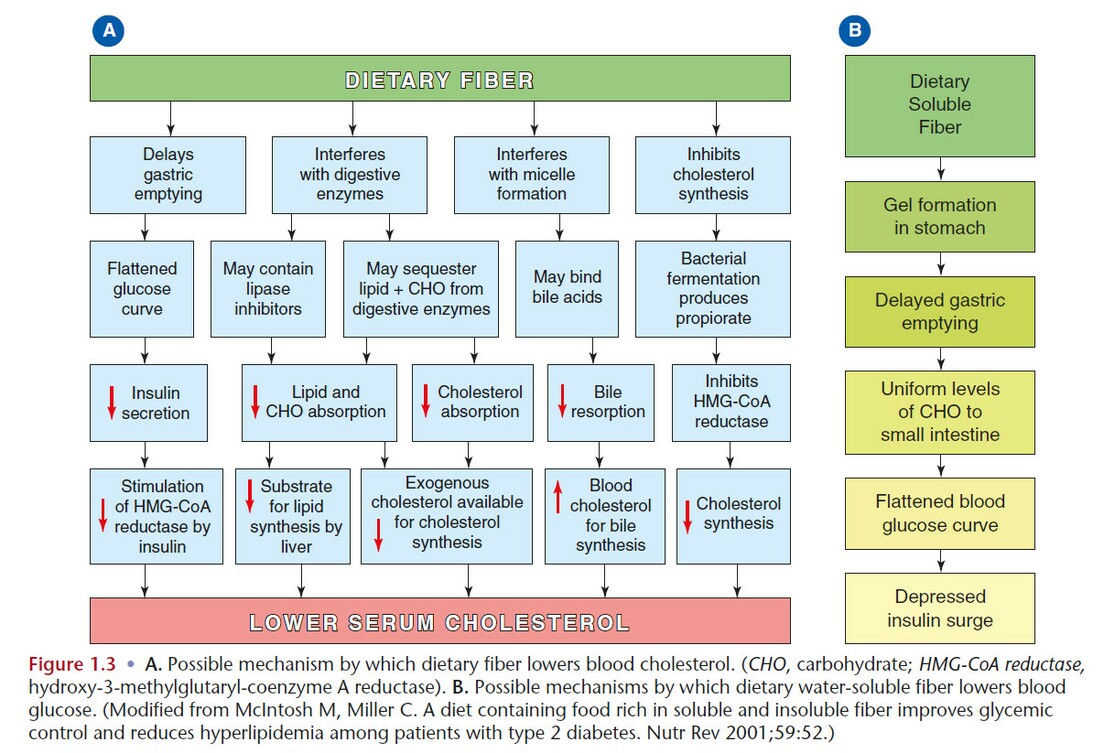
Влияние на здоровье дефицита волокон в пище. Употребление большого количества волокон, особенно с цельнозерновыми крупами, ассоциировано с более низкой встречаемостью у таких лиц ожирения, системных воспалительных заболеваний, инсулинорезистентности и сахарного диабета 2 типа, гипертонии, метаболического синдрома, заболеваний пищеварительного тракта, повышенного уровня холестерина и заболеваний сердца.
Рекомендуется потреблять в сутки:
38 грамм волокон мужчинам до 50 лет;
25 грамм волокон женщинам до 50 лет;
30 грамм волокон мужчинам после 50 лет;
21 грамм волокон женщинам после 50 лет.
Волокна содержат воду и формируют каловые массы в кишечнике.
Рекомендуется потреблять в сутки:
38 грамм волокон мужчинам до 50 лет;
25 грамм волокон женщинам до 50 лет;
30 грамм волокон мужчинам после 50 лет;
21 грамм волокон женщинам после 50 лет.
Волокна содержат воду и формируют каловые массы в кишечнике.

Потребление волокон умеренно снижает уровень холестерина, снижая фракцию липопротеидов низкой плотности.
Особенно эффективны водорастворимые полисахариды, слизистые волокна, такие как в шелухе семян подорожника (псиллиум), бета-глюкан, пектин и гауровая камедь, которые содержатся в овсе, фасоли, коричневом рисе, горохе, моркови, кукурузе и многих фруктах. Диетические волокна не оказывают влияние на ЛПВП.
Водонерастворимые волокна – целлюлоза, многие формы гемицеллюлозы и легнин, и богатые целлюлозой продукты не понижают холестерин. Протективная роль клетчатки на рак прямой кишки остается спорным вопросом.
Особенно эффективны водорастворимые полисахариды, слизистые волокна, такие как в шелухе семян подорожника (псиллиум), бета-глюкан, пектин и гауровая камедь, которые содержатся в овсе, фасоли, коричневом рисе, горохе, моркови, кукурузе и многих фруктах. Диетические волокна не оказывают влияние на ЛПВП.
Водонерастворимые волокна – целлюлоза, многие формы гемицеллюлозы и легнин, и богатые целлюлозой продукты не понижают холестерин. Протективная роль клетчатки на рак прямой кишки остается спорным вопросом.
Протективная роль диетических волокон от заболеваний сердца и ожирения, связана со снижением секреции инсулина путем замедления всасывания питательных веществ в тонком кишечник, получаемых из пищи. Употребление волокон может также защищать от заболеваний сердца через положительное влияние на артеральное давление, чувствительность инсулина и характеристику свертываемости крови.
Отрицательное сторона излишнего потребления волокон – это ингибирование всасывание в тонком кишечнике солей кальция, фосфора и железа.
В настоящее время рекомендуется диетическое питание, содержащее от 20 до 40 г волокон (в зависимости от возраста) в день в соотношении 3:1 водонерастворимых к водорастворимым.
В таблице 2 представлено еждневное меню на 2200 ккал, которое включает 31 г волокон (21 г нерастворимых волокон).
Отрицательное сторона излишнего потребления волокон – это ингибирование всасывание в тонком кишечнике солей кальция, фосфора и железа.
В настоящее время рекомендуется диетическое питание, содержащее от 20 до 40 г волокон (в зависимости от возраста) в день в соотношении 3:1 водонерастворимых к водорастворимым.
В таблице 2 представлено еждневное меню на 2200 ккал, которое включает 31 г волокон (21 г нерастворимых волокон).
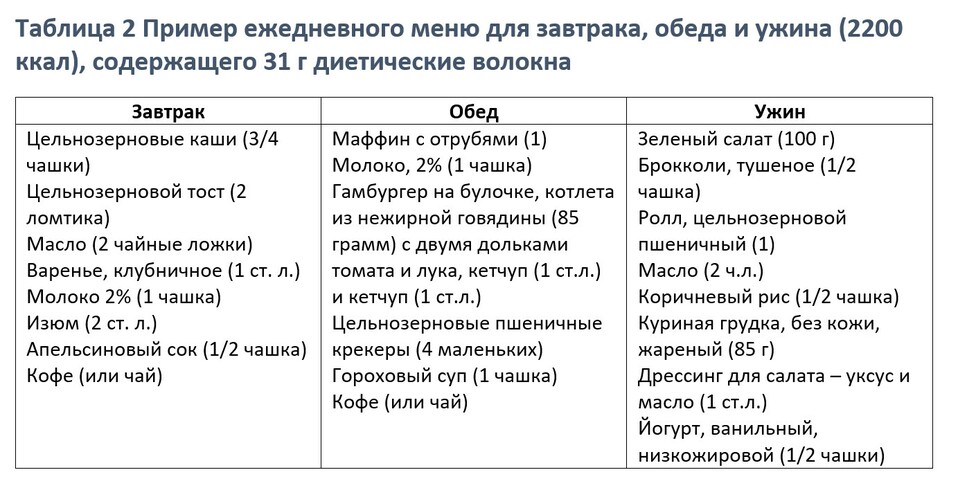
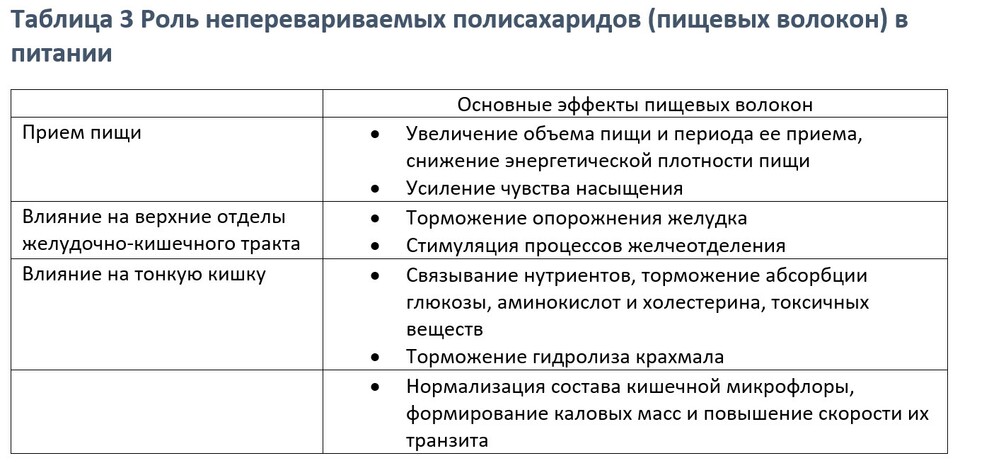
Рисунок ниже показывает возможные механизмы, которыми пищевые волокна снижают уровень холестерина в крови (А) и глюкозы (В)
Перевариваемые углеводы в тонком кишечнике расщепляются до дисахаридов, а далее - до моносахаридов.
Не все углеводы физиологически эквиваленты. Скорость переваривания различных источников углеводов объясняет связь между употреблением углеводов, диабетом и ожирением. Продукты, содержащие диетические волокна, замедляют переваривание углеводов минимизируя подъем уровня сахара в крови. Тогда как продукты бедные клетчаткой – крахмалы (и простые сахара, например, в мягких напитках) перевариваются и поступают в кровь очень быстро (продукты с высоким гликемическим индексом). Уровень глюкозы повышается в крови после употребления рафинированных, процессированных крахмалов и простых сахаров, стимулируя избыточную выработку инсулина поджелудочной железой, вызывая гиперсинулинемию и ускоренный синтез жира. Постоянное употребление таких продуктов может снизить чувствительность к инсулину (то есть периферические ткани становятся более резистентными к эффектам инсулина) и таким образом требуется больше инсулина, чтобы нормализовать уровень сахара в крови. Сахарный диабет 2 типа развивается когда поджелудочная железа не может продуцировать достаточное количество инсулина, чтобы регулировать уровень глюкозы в крови, что приводит к повышению сахара в крови.
Регулярные физические упражнения улучшают чувствительность тканей к инсулину и таким образом снижают потребность в инсулине для данного количества глюкозы в крови.
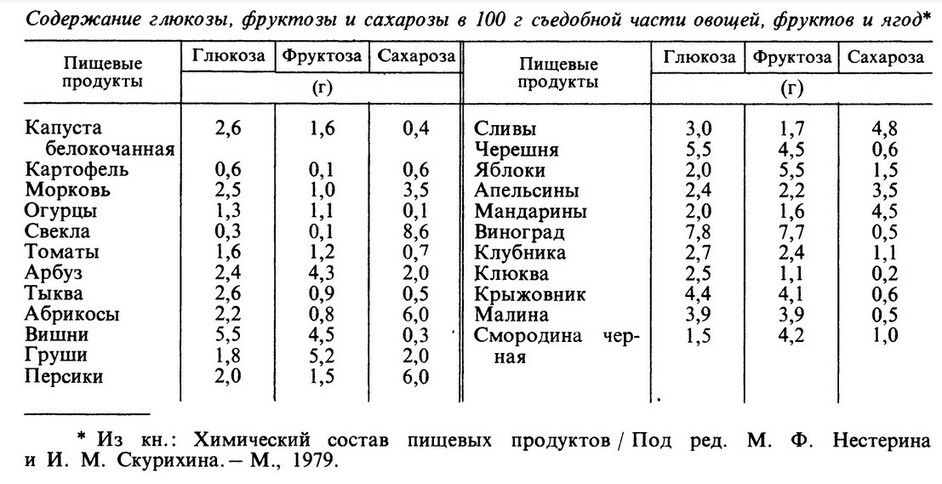
Простые углеводы, а также крахмал и гликоген усваиваются хорошо. Особенно быстро всывается из кишечника глюкоза, медленнее - фруктоза, источниками которых являются фрукты, ягоды и некоторые овощи и мед. Глюкоза и фруктоза наиболее быстро усваиваются и используются в организме. Глюкоза - главный поставщик энергии для мозга. Фруктоза не требует для своего усвоения гормона инсулина, что позволяет рекомендовать ее источники при сахарном диабете. Фруктоза лекче, чем глюкоза участвует в липогенезе. Основными источниками сахарозы служат сахар, кондитерские изделия, варенье, мороженое, сладкие напитки, а также некоторые овощи и фрукты. В кишечнике сахароза рассщепляется на глюкозу и фруктозу. Лактоза содержится в молочных продуктах. Лактоза нормализует деятельность полезной кишечной микрофлоры, уменьшает процессы гниения в кишечнике. В кисломолочных продуктах лактозы меньше, чем в молоке, так как при сквашивании молока из лактозы образуется молочная кисота.
Если сладость сахарозы (обычного сахара) принять за 100, то
сладость фруктозы составляет 173
глюкозы - 74
лактозы - 16.
Мальтоза (солодовый сахар) - промежуточный продукт расщепления крахмала пищеварительными ферментами и фермантами проросшего зерна (солода). Образующаяся мальтоза распадается до глюкозы. В свободном виде мальтоза содержится в меде, экстракте из солода (патоке мальтозной), солодовом молокое, пиве.
Крахмал составляет около 80% всего углеводов в питании человека.
Содержание крахмала в г на 100 г съедобной части продктов:
мука пшеничная и ржаная - 60-68 ;
крупа манная, пшеничная, рис - 68-73;
крупа гречневая, преловая, пшено - 65;
крупа овсяная - 55;
горох, фасоль - 43-47;
макаронные изделия - 68;
хлеб ржаной - 40-50;
хлеб пшеничный - 47-53;
печенье - 51-56;
картофель - 18;
зеленый горошек - 7;
тыква, бананы - 2;
капуста белокачанная, морковь, томаты - 0,2-0,5.
Крахмал медленно переваривается, расщепляясь до глюкозы. Легче и быстрее переваривается крамал из риса и манной крупы, чем из пшена, гречневой и преловой и яневой круп, из картофеля и хлеба - сравнительно с горохом и фасолью. Крахмал в натуральном виде, например в киселях, усваивается очень быстро. Затрудняет усвоение крахмала поджаривание круп.
Регулярные физические упражнения улучшают чувствительность тканей к инсулину и таким образом снижают потребность в инсулине для данного количества глюкозы в крови.
Простые углеводы, а также крахмал и гликоген усваиваются хорошо. Особенно быстро всывается из кишечника глюкоза, медленнее - фруктоза, источниками которых являются фрукты, ягоды и некоторые овощи и мед. Глюкоза и фруктоза наиболее быстро усваиваются и используются в организме. Глюкоза - главный поставщик энергии для мозга. Фруктоза не требует для своего усвоения гормона инсулина, что позволяет рекомендовать ее источники при сахарном диабете. Фруктоза лекче, чем глюкоза участвует в липогенезе. Основными источниками сахарозы служат сахар, кондитерские изделия, варенье, мороженое, сладкие напитки, а также некоторые овощи и фрукты. В кишечнике сахароза рассщепляется на глюкозу и фруктозу. Лактоза содержится в молочных продуктах. Лактоза нормализует деятельность полезной кишечной микрофлоры, уменьшает процессы гниения в кишечнике. В кисломолочных продуктах лактозы меньше, чем в молоке, так как при сквашивании молока из лактозы образуется молочная кисота.
Если сладость сахарозы (обычного сахара) принять за 100, то
сладость фруктозы составляет 173
глюкозы - 74
лактозы - 16.
Мальтоза (солодовый сахар) - промежуточный продукт расщепления крахмала пищеварительными ферментами и фермантами проросшего зерна (солода). Образующаяся мальтоза распадается до глюкозы. В свободном виде мальтоза содержится в меде, экстракте из солода (патоке мальтозной), солодовом молокое, пиве.
Крахмал составляет около 80% всего углеводов в питании человека.
Содержание крахмала в г на 100 г съедобной части продктов:
мука пшеничная и ржаная - 60-68 ;
крупа манная, пшеничная, рис - 68-73;
крупа гречневая, преловая, пшено - 65;
крупа овсяная - 55;
горох, фасоль - 43-47;
макаронные изделия - 68;
хлеб ржаной - 40-50;
хлеб пшеничный - 47-53;
печенье - 51-56;
картофель - 18;
зеленый горошек - 7;
тыква, бананы - 2;
капуста белокачанная, морковь, томаты - 0,2-0,5.
Крахмал медленно переваривается, расщепляясь до глюкозы. Легче и быстрее переваривается крамал из риса и манной крупы, чем из пшена, гречневой и преловой и яневой круп, из картофеля и хлеба - сравнительно с горохом и фасолью. Крахмал в натуральном виде, например в киселях, усваивается очень быстро. Затрудняет усвоение крахмала поджаривание круп.
Животные полисахариды
Гликоген – это углевод, откладывающийся в печени и мышцах млекопитающих. Это большой полисахаридный полимер, синтезируемый из глюкозы в процессе глюкогенеза (катализируемый ферментом гликоген-синтетазой). Неправильной формой гликоген насчитывает от нескольких сотен до 30 000 молекул глюкозы, соединенных вместе, с ответвлениями для присоединения дополнительных молекул глюкозы. Его компактная структура образует плотные гранулы внутри клеток, которые различаются в структуре и локализации внутри клетки, метаболической регуляции и ответе. Эти гликосомы содержат гликоген и протеины, регулирующие его метаболизм.
Хитин - важный структурный полисахарид беспозвоночных. Из него построен наружный скелет ракообразных и насекомых.
Глюкозаминогликаны (мукополисахариды) состоят из цепей сложных углеводов, содержащих аминосахара и уроновые кислоты. Если цепи присоединены к белковой молекуле, соответствующее соединение называют протеогликаном. Глюкозаминогликаны как основное скрепляющее вещество связаны со структурными компонентами, входящими в состав костей, а также эластином и коллагеном. Их функция состоит в удержании большой массы воды и в заполнении межклеточного пространства. Они служат смягчающим и смазочным материалом для разного рода тканевых структур. Примерами служат гиалуроновая кислота, хондроитинсульфат и гепарин.
Гликопротеины (мукопротеины) - протеины, содержащие разветвленные и неразветвленные олигосахаридные цепи, включая фукозу. Они встречаются в клеточных мембранах. Сиаловые кислоты - производные нейромидиновой кислоты. Сиаловые кислоты являются компонентом гликопротеинов и ганглиозидов.
Хитин - важный структурный полисахарид беспозвоночных. Из него построен наружный скелет ракообразных и насекомых.
Глюкозаминогликаны (мукополисахариды) состоят из цепей сложных углеводов, содержащих аминосахара и уроновые кислоты. Если цепи присоединены к белковой молекуле, соответствующее соединение называют протеогликаном. Глюкозаминогликаны как основное скрепляющее вещество связаны со структурными компонентами, входящими в состав костей, а также эластином и коллагеном. Их функция состоит в удержании большой массы воды и в заполнении межклеточного пространства. Они служат смягчающим и смазочным материалом для разного рода тканевых структур. Примерами служат гиалуроновая кислота, хондроитинсульфат и гепарин.
Гликопротеины (мукопротеины) - протеины, содержащие разветвленные и неразветвленные олигосахаридные цепи, включая фукозу. Они встречаются в клеточных мембранах. Сиаловые кислоты - производные нейромидиновой кислоты. Сиаловые кислоты являются компонентом гликопротеинов и ганглиозидов.

Сколько запасов гликогена в организме?
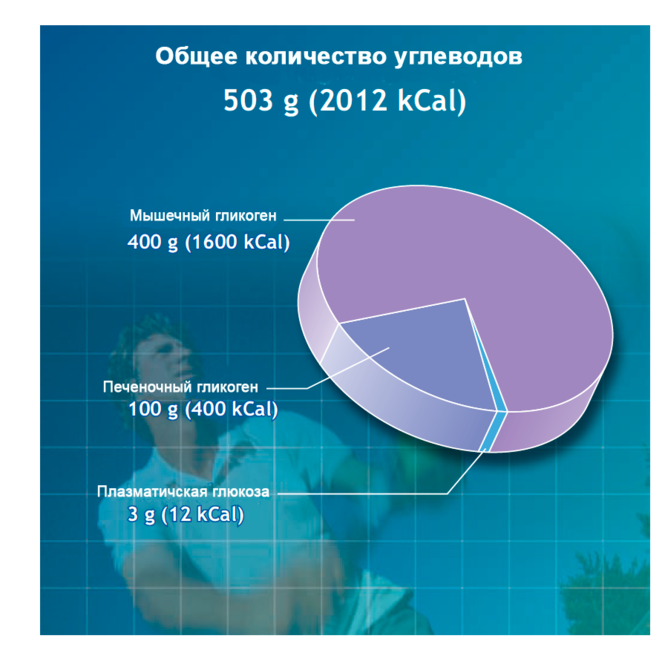
Общее количество углеводов в теле 80 кг мужчины достигает 2000 ккал (около 500 грамм), этой энергии достаточно, чтобы пробежать 32 км. Тело хранит сравнительно мало гликогена, так его количество изменяется из-за диетических предпочтений и влияний. Например, 24 часовое голодание или низкоуглеводная диета при нормальной калорийности почти полностью истощает запасы гликогена, и наоборот, богатая углеводами диета почти дважды увеличивает запасы гликогена в теле в сравнении со среднестатистической сбалансированной диетой.
Верхний предел отложения гликогена – около 15 грамм на 1 кг массы тела, что эквивалентно 1050 граммам на 70 кг мужчины или 840 грамм у 56 кг женщины.
Верхний предел отложения гликогена – около 15 грамм на 1 кг массы тела, что эквивалентно 1050 граммам на 70 кг мужчины или 840 грамм у 56 кг женщины.
Понятие о метаболизме
Метаболизм - это термин, который описывает взаимопревращение химических соединений в организме, путями, отобранными для каждой молекулы, их взаимодействия и механизмы, которые регулируют поток метаболитов через эти пути.
Метаболический путь распадается на три категории:
1. Анаболический путь - в котором вовлечены в процесс синтеза крупных и более комплексных соединений из более мелких предшественников, например, синтез белка из аминокислот или синтез резерва триациглицерола и гликогена. Анаболические пути эндотермические.
2. Катаболический путь - в котором происходит распад крупных молекул, обычно вовлеченных в окислительные реакции; катаболические пути являются экзотермическими, производят уменьшенные эквиваленты, и обычно через респираторную цепь.
3. Амфиболический путь - выполняет функцию "перекрестка" метаболизма, работая, как связующее звено между анаболическим и катаболическим путем, примером служит цикл лимонной кислоты.
Для нормального метаболизма характерны адаптационные изменения в период голодания, при физической нагрузке, в состояниях беременности и лактации. Нарушения метаболизма возникают, например, при недостаточности питания, дефиците тех или иных ферментов, дисбалансе гормонов или действии лекарств и токсинов.
70 кг человеку требуется 1920-2900 ккал: 40-60% из углеводов; 30-40% из жиров (в основном из триацилглицеролов) и 10-15% из белков.
Смесь белков жиров и углеводов окисляется в зависимости от того является ли лицо голодным или сытым, длительности и интенсивности физической нагрузки.
Физическая активность увеличивает скорость метаболизма только на 40-50% от базального уровня покоя. Если прием метаболического топлива постоянно больше чем энергетические затраты, то излишки откладываются обильно в форме триацилглицеролов, приводя к развитию ожирения, что создает риски для здоровья. И наоборот, если прием метаболического топлива постоянно нижне энерегетических затрат, это истощяет резервы жира и углеводов, а аминокислоты вделяются из белков, и используются в энергетическом метаболизме, приводя к истощению, и даже смерти.
В насыщенном состоянии, после еды, образуется обильное снабжение углеводами, а метаболическим топливо для большинства тканей является глюкоза. При голодании, глюкоза должна запасаться для использования центральной нервной системой (которая сильно зависит от глюкозы) и эритроцитами (которые полностью зависят от глюкозы). Таким образом, имеются ткани, которые могут использовать другие источники энергии, кроме глюкозы; мышцы и печень окисляют жирные кислоты, а в печени синтезируются кетоновые тельца из жирных кислот для экспорта в мышцы и другие ткани. Так как резервы гликогены становятся истощены, аминокислоты выделяются из белков и используются для глюконеогенеза.
Образование и утилизация резервов триацилглицеролов и гликогенов и распределение в тканях для захвата и окисления по больше частью контролируются гормонами инсулином и глюкагоном. При сахарном диабете может быть как нарушение синтеза и секреции инсулина (тип I диабета), или нарушение чувствительности ткани действию инсулина (тип II), что приводит к тяжелым метаболическим нарушениям.
Метаболический путь распадается на три категории:
1. Анаболический путь - в котором вовлечены в процесс синтеза крупных и более комплексных соединений из более мелких предшественников, например, синтез белка из аминокислот или синтез резерва триациглицерола и гликогена. Анаболические пути эндотермические.
2. Катаболический путь - в котором происходит распад крупных молекул, обычно вовлеченных в окислительные реакции; катаболические пути являются экзотермическими, производят уменьшенные эквиваленты, и обычно через респираторную цепь.
3. Амфиболический путь - выполняет функцию "перекрестка" метаболизма, работая, как связующее звено между анаболическим и катаболическим путем, примером служит цикл лимонной кислоты.
Для нормального метаболизма характерны адаптационные изменения в период голодания, при физической нагрузке, в состояниях беременности и лактации. Нарушения метаболизма возникают, например, при недостаточности питания, дефиците тех или иных ферментов, дисбалансе гормонов или действии лекарств и токсинов.
70 кг человеку требуется 1920-2900 ккал: 40-60% из углеводов; 30-40% из жиров (в основном из триацилглицеролов) и 10-15% из белков.
Смесь белков жиров и углеводов окисляется в зависимости от того является ли лицо голодным или сытым, длительности и интенсивности физической нагрузки.
Физическая активность увеличивает скорость метаболизма только на 40-50% от базального уровня покоя. Если прием метаболического топлива постоянно больше чем энергетические затраты, то излишки откладываются обильно в форме триацилглицеролов, приводя к развитию ожирения, что создает риски для здоровья. И наоборот, если прием метаболического топлива постоянно нижне энерегетических затрат, это истощяет резервы жира и углеводов, а аминокислоты вделяются из белков, и используются в энергетическом метаболизме, приводя к истощению, и даже смерти.
В насыщенном состоянии, после еды, образуется обильное снабжение углеводами, а метаболическим топливо для большинства тканей является глюкоза. При голодании, глюкоза должна запасаться для использования центральной нервной системой (которая сильно зависит от глюкозы) и эритроцитами (которые полностью зависят от глюкозы). Таким образом, имеются ткани, которые могут использовать другие источники энергии, кроме глюкозы; мышцы и печень окисляют жирные кислоты, а в печени синтезируются кетоновые тельца из жирных кислот для экспорта в мышцы и другие ткани. Так как резервы гликогены становятся истощены, аминокислоты выделяются из белков и используются для глюконеогенеза.
Образование и утилизация резервов триацилглицеролов и гликогенов и распределение в тканях для захвата и окисления по больше частью контролируются гормонами инсулином и глюкагоном. При сахарном диабете может быть как нарушение синтеза и секреции инсулина (тип I диабета), или нарушение чувствительности ткани действию инсулина (тип II), что приводит к тяжелым метаболическим нарушениям.
Пути метаболизма
Все продукты пищеварения (белки, жиры, углеводы) метаболизируются до общего продукта, ацетил-СоА, который затем окисляется в цикле лимонной кислоты.
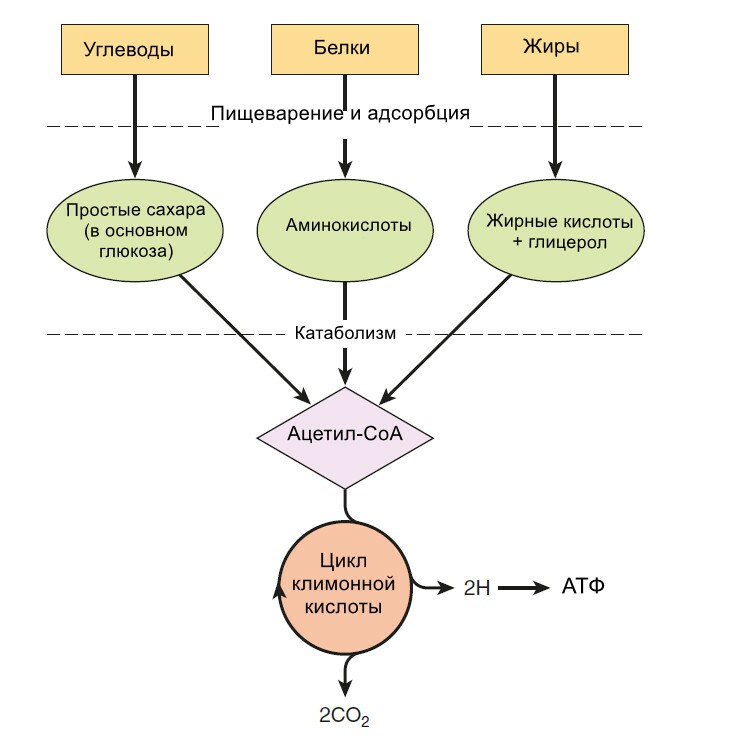
Метаболизм углеводов сконцентрирован на производстве и распаде глюкозы
Глюкоза - это основной источник энергии для большинства тканей. Она метаболизируется из пирувата по пути гликолиза. Аэробные ткани метаблизируют пирувать до ацетил-СоА, который заходит в цикл лимонной кислоты для окисления до СО2 и Н2О, и связан с образованием АТФ в процессе окислительного фосфорилирования. Гликолиз может также протекать анаэробно (в отсутствии кислорода), тогда конечным продуктом является лактат.
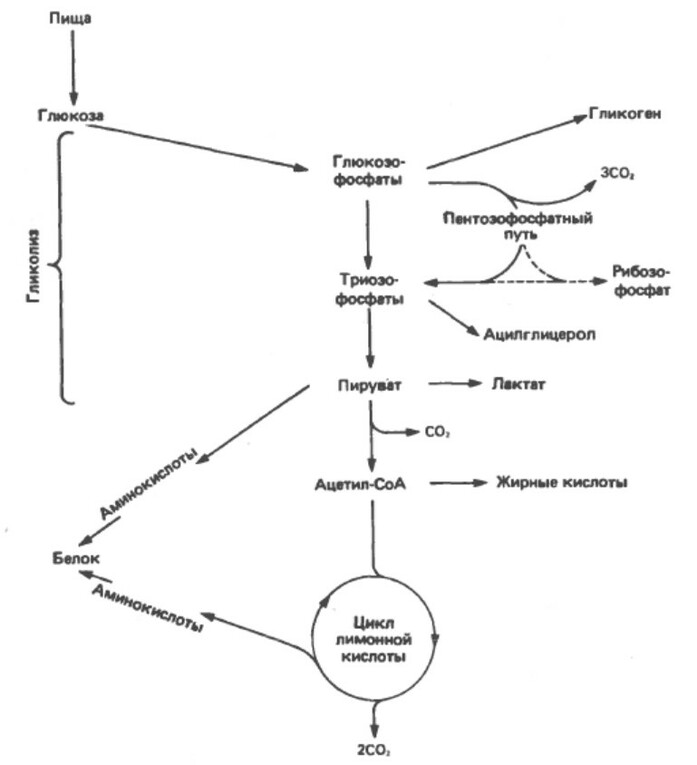
Глюкоза и ее метаболиты принимают участие и вдругих процессах, например:
1. Синтезе полимера гликогена в скелетных мышцах и печени,
2. Субстрат пентозофосфатного пути - альтернативный путь гликолиза. Он является источником редуционных (восстановительных) эквивалентов (NADPH) для синтеза жирных кислот.
3. Триозофосфат, образующийся на одной из стадий гликолиза, является источником глицерола, используемого в синтезе ацилглицеролов.
4. Пируват и ряд промежуточных соединений лимонной кислоты - это источники углеродных скелетов, используемых в синтезе аминокислот.
5. Ацетил-СоА - служит основным строительным блоком в синтезе длоинноцепочечных жирных кислот и холестерола - предшественника всех синтезируемых в организме стероидов.
1. Синтезе полимера гликогена в скелетных мышцах и печени,
2. Субстрат пентозофосфатного пути - альтернативный путь гликолиза. Он является источником редуционных (восстановительных) эквивалентов (NADPH) для синтеза жирных кислот.
3. Триозофосфат, образующийся на одной из стадий гликолиза, является источником глицерола, используемого в синтезе ацилглицеролов.
4. Пируват и ряд промежуточных соединений лимонной кислоты - это источники углеродных скелетов, используемых в синтезе аминокислот.
5. Ацетил-СоА - служит основным строительным блоком в синтезе длоинноцепочечных жирных кислот и холестерола - предшественника всех синтезируемых в организме стероидов.
Метаболизм жиров сконцентрирован в основном на жирных кислотах и холестероле
Источником длинноцепочечных жирных кислот служат пищевые липиды или синтез de novo из ацетил-СоА, который в свою очередь оразуется из углеводов или аминокислот. Жирные кислоты могут окисляться до ацетил-СоА (бета-окисление) или эстерифицироваться с глицеролом с образованием триацилглицерола, как главный резерв энергии.
Ацетил-СоА образуемый при бета-окислении, участвует в ряде важных процессов:
Ацетил-СоА образуемый при бета-окислении, участвует в ряде важных процессов:
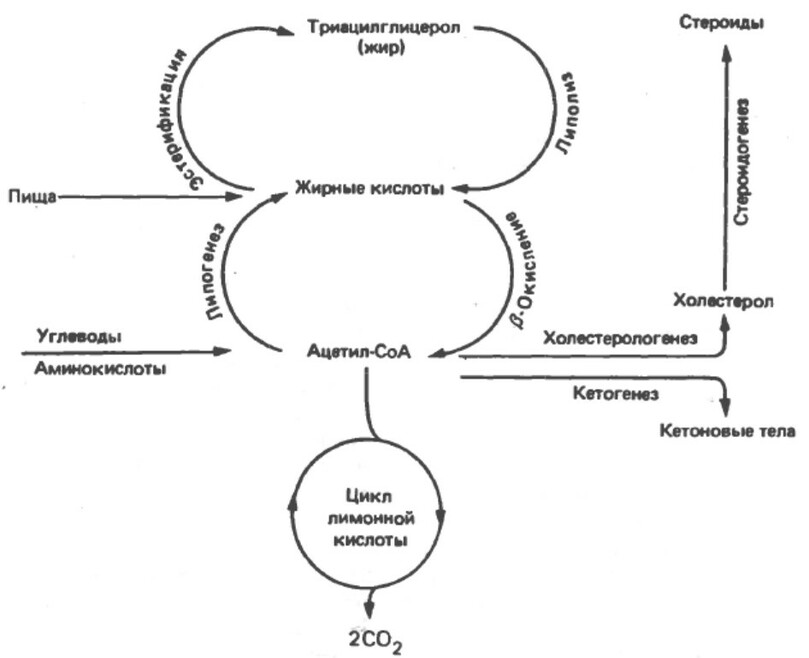
1. Ацетил-СоА моженость полностью окисляться до СО2+Н2О в цикле лимонной кислоты.
2. Ацетил-СоА является предшественником для синтеза холестерола и других стероидов, в качестве источников атомов углерода.
3. В печени из него образуются кетоновые тела - ацетоацетат и 3-гидроксиутират, которые служат важными источниками энергии при длительном голодании.
2. Ацетил-СоА является предшественником для синтеза холестерола и других стероидов, в качестве источников атомов углерода.
3. В печени из него образуются кетоновые тела - ацетоацетат и 3-гидроксиутират, которые служат важными источниками энергии при длительном голодании.
Метаболизм аминокислот
Аминокислоты необходимы для синтеза белков. Некоторые должны поступать с пищей (незаменимые аминокислоты), так как их организм не способен синтезировать, остальные аминокислоты (заменимые), также поступают с пищей, но могут образовываться из промежуточных метаболитов путем переаминирования, то есть переноса аминогрупп от других аминокислот, присутствующих в избыточном количестве. После дезаминирования избыточный аминный азот удаляется в составе мочевины; оставшийся углеродный скелет может:
1. окисляться до СО2 в цикле лимонной кислоты;
2. использоваться для синтеза глюкозы (глюконеогенез);
3. образовывать кетоновые тела или ацетил-СоА, который может окисляться или использоваться для синтеза жирных кислот.
1. окисляться до СО2 в цикле лимонной кислоты;
2. использоваться для синтеза глюкозы (глюконеогенез);
3. образовывать кетоновые тела или ацетил-СоА, который может окисляться или использоваться для синтеза жирных кислот.
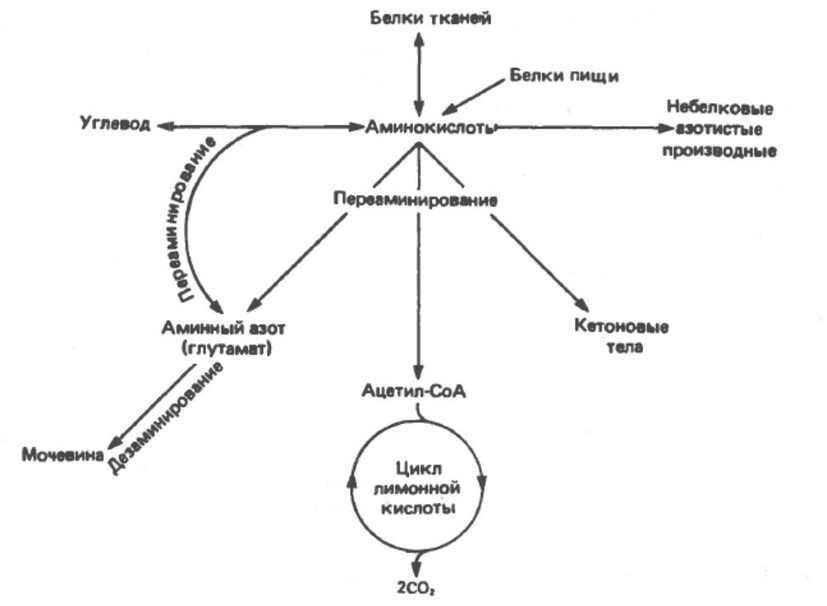
Несколько аминокислот могут служить предшественниками для других соединений, например, пуринов, пиримидинов, гормонов, таких как адреналина и тироксина, а также нейротрасмиттеров.
Аденозин-трифосфат (АТФ): переносчик энергии
Энерегия из продуктов не переносият напрямую клеткам, для биологической работы, также, как энергия от окисления макровеществ накапливается и сосредоточивается в энерегетически богатых соединениях аденозин-трисфосфата (АТФ). Потенциальная энергия внутри нуклеотидной молекулы снабжает энергией ВСЕ энергетические процессы клетки. АТФ представляет две основные энерегетически-передающие деятельности:
1. Извлекает потенциальную энерегию из пищи и превращает ее во внутренние связи АТФ.
2. Извлекает и передает химическую энергию из АТФ в энергиюю биологической работы.
Клетки содержат и другие высокоэнергетические соединения (фосфоэнолпируват, 1.3-дифосфоглицерат; фосфокреатин), но АТФ наиболее важная.
1. Извлекает потенциальную энерегию из пищи и превращает ее во внутренние связи АТФ.
2. Извлекает и передает химическую энергию из АТФ в энергиюю биологической работы.
Клетки содержат и другие высокоэнергетические соединения (фосфоэнолпируват, 1.3-дифосфоглицерат; фосфокреатин), но АТФ наиболее важная.
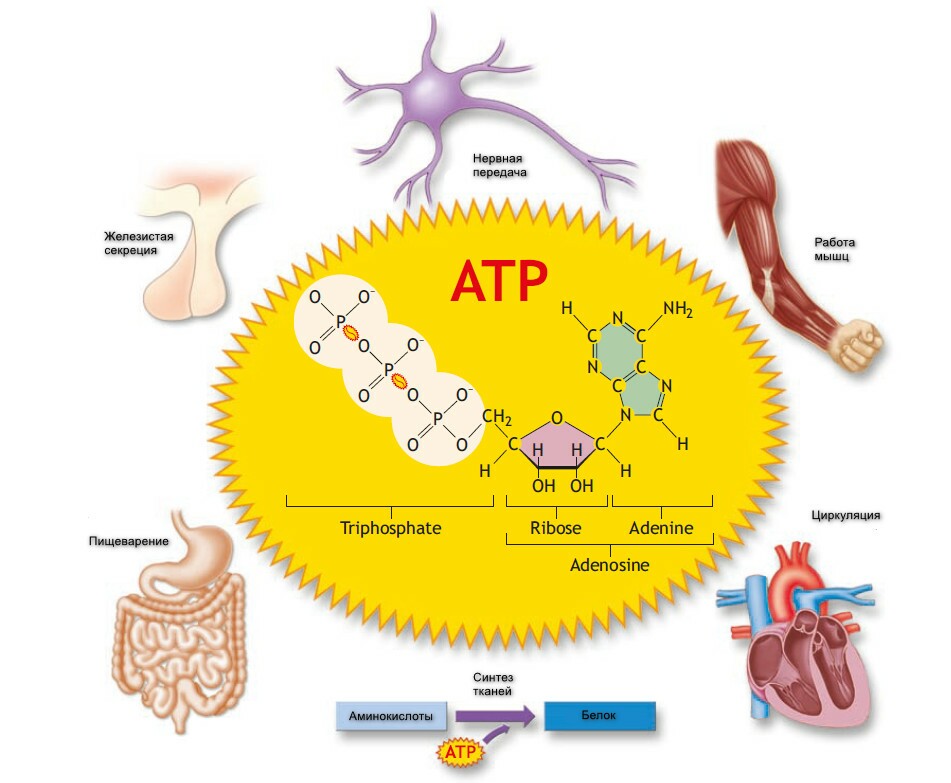
Рисунок демонстрирует, как образуется АТФ из трех молекул аденина, рибозы (вместе называемых аденозин) и трех молеул фосфата, содержащих фосфор и атомы кислорода. Соединия, которые связывает крайние фосфаты, представляет высокоэнергические связи, так как они высвобождают значительную энергию во время гидролиза.
Новое соединение, аденозин-дифосфат (АДФ), образуется когда АТФ присоединяет воду, катализируется ферментом, называемым аденозин-трифосфатаза (АТФ-аза). Эта реакция отщепляет наружную фосфатную связь и высфобождат ион фосфора (неорганический фосфор) и выделеят 7.3 ккал свободной энерегии, или dG - энерегии, доступной для работы - на моль АТФ, гидролизируемого до АДФ. Во внеклеточном пространстве эта энергия может достигать 10 ккал/моль.
В некоторых реакциях может донироваться еще одна терминальная фосфатная связь, с образованием аденозин-монофосфата (АМФ), который остается одна фосфатная группа.
Энергия АТФ гидролизирует энергию для всех форм биологической работы; таким образом, АТФ рассматривается, как клеточный "переносчик энерегии".
АТФ распадается практически моментально без кислорода. Эта способность гидролизировать АТФ анэробно с образованием быстрой энергии не происходит, если энергетический метаболизм требует кислород все время. Движения тела требуют такой энерегии, и она практически полностью происходит через гидролиз внутримышечных АТФ.
Организм поддерживает постоянное снабжение АТФ через различные метаболические пути; некоторые локализованы в клеточном цитозоле, другие - в митохондриях.
Новое соединение, аденозин-дифосфат (АДФ), образуется когда АТФ присоединяет воду, катализируется ферментом, называемым аденозин-трифосфатаза (АТФ-аза). Эта реакция отщепляет наружную фосфатную связь и высфобождат ион фосфора (неорганический фосфор) и выделеят 7.3 ккал свободной энерегии, или dG - энерегии, доступной для работы - на моль АТФ, гидролизируемого до АДФ. Во внеклеточном пространстве эта энергия может достигать 10 ккал/моль.
В некоторых реакциях может донироваться еще одна терминальная фосфатная связь, с образованием аденозин-монофосфата (АМФ), который остается одна фосфатная группа.
Энергия АТФ гидролизирует энергию для всех форм биологической работы; таким образом, АТФ рассматривается, как клеточный "переносчик энерегии".
АТФ распадается практически моментально без кислорода. Эта способность гидролизировать АТФ анэробно с образованием быстрой энергии не происходит, если энергетический метаболизм требует кислород все время. Движения тела требуют такой энерегии, и она практически полностью происходит через гидролиз внутримышечных АТФ.
Организм поддерживает постоянное снабжение АТФ через различные метаболические пути; некоторые локализованы в клеточном цитозоле, другие - в митохондриях.
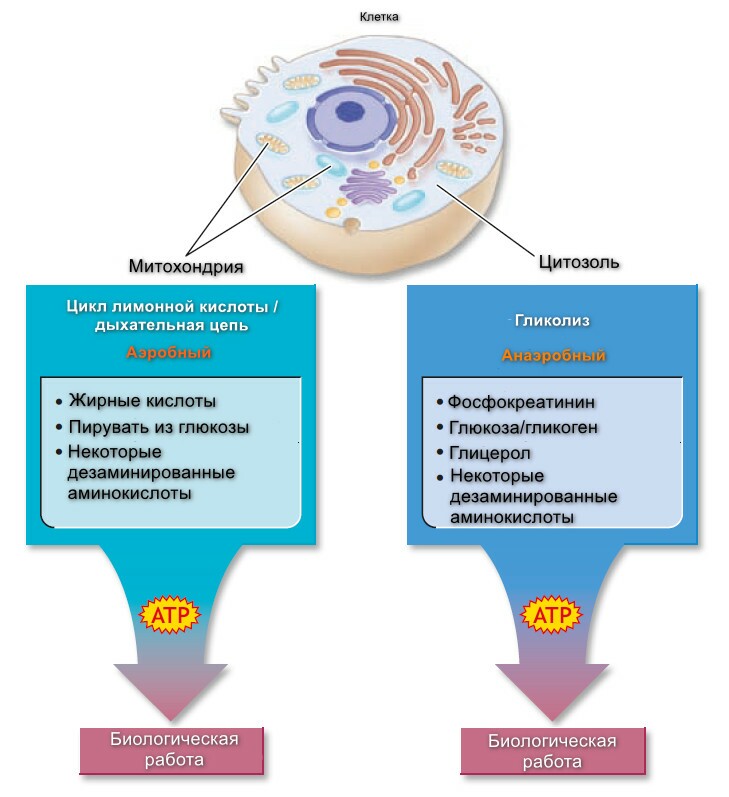
Три реактивных процесса используют клеточную энерегию, чтобы генерировать АТФ аэробно - цикл лимонной кислоты (с углеводами), бета-окисление (с липидами) и дыхательная цепь - расположенная в митохондриях.
АТФ - ограниченый переносчик. Клетки содержат небольшое количество АТФ и таким образом, постоянно должны синтезировать их по мере использования. Только при эксримальных упражнениях уровень АТФ в поперечно-полосатых мышцах снижается. Ограниченное снабжение АТФ обеспечивает биологическую пользу механизма регулирования энергетического метаболизма. Поддерживается только минимальное количество АФТ, и его концетрация быстро изменяется в ответ на минимальное снижение АТФ. Нарушение баланса стимулирует разрушение других энергетически высоких соединений для ресинтеза АТФ. Таким образом, начало мышечной работы быстро активизирует несолько систем для увеличения энерегического превращения. И это увеличение зависит от интенсивность работы. Так превращение энерегии в 4 раза выше при ходьбе, чем при сидении на стуле. Изменение ходьбы на спринтовский бег, почти моментально увеличивает превращение в мышцах приблизительно в 120 раз.
Организм откладывает только 80-100 г АТФ в любом спокойном состоянии. Количество, которое требуется каждую секунду приблизительно 2.4 ммоль АТФ на кг мышечного веса. Это отражает достаточное количество хранящейся внутримышечной энергии для взрывной или другого вида работы. Однако, АТФ отдельно существенно не отражает энергетические резервы. Средне человек ежедневно ресинтезирует около 75% от собственного веса количество АТФ. 80 кг АТФ ресинтезируется во время бега!
АТФ - ограниченый переносчик. Клетки содержат небольшое количество АТФ и таким образом, постоянно должны синтезировать их по мере использования. Только при эксримальных упражнениях уровень АТФ в поперечно-полосатых мышцах снижается. Ограниченное снабжение АТФ обеспечивает биологическую пользу механизма регулирования энергетического метаболизма. Поддерживается только минимальное количество АФТ, и его концетрация быстро изменяется в ответ на минимальное снижение АТФ. Нарушение баланса стимулирует разрушение других энергетически высоких соединений для ресинтеза АТФ. Таким образом, начало мышечной работы быстро активизирует несолько систем для увеличения энерегического превращения. И это увеличение зависит от интенсивность работы. Так превращение энерегии в 4 раза выше при ходьбе, чем при сидении на стуле. Изменение ходьбы на спринтовский бег, почти моментально увеличивает превращение в мышцах приблизительно в 120 раз.
Организм откладывает только 80-100 г АТФ в любом спокойном состоянии. Количество, которое требуется каждую секунду приблизительно 2.4 ммоль АТФ на кг мышечного веса. Это отражает достаточное количество хранящейся внутримышечной энергии для взрывной или другого вида работы. Однако, АТФ отдельно существенно не отражает энергетические резервы. Средне человек ежедневно ресинтезирует около 75% от собственного веса количество АТФ. 80 кг АТФ ресинтезируется во время бега!
Фосфокреатинин: энергетический резервуар
Из-за ограничения по объемам хранения, АТФ ресинтезируется постоянно и непрерывно, для снабжения энергией организм. Жиры и гликоген представляют основные энерегитечкие ресурсы для поддержания ресинтеза необходимого АТФ. Некоторая энергия для ресинтеза АТФ также приходит через анаэробное отделение фосфата от фосфокреатинина (PCr), другого высокоэнергетического соединения. На рисунке схематически представлено высвобождение и использование энергии фосфатной связи в АТФ и РСr.
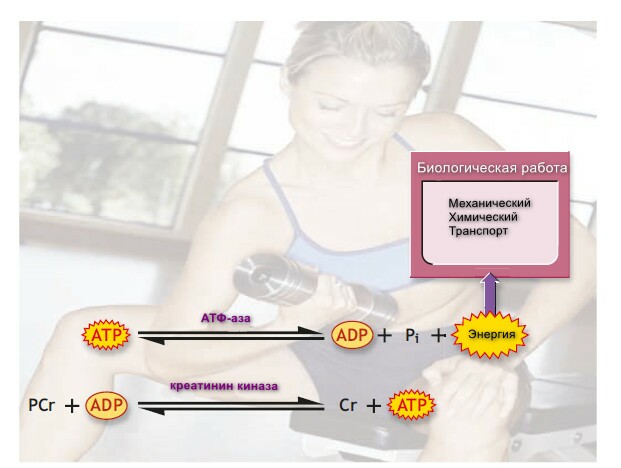
PCr и АТФ молекулы имеют сходные характеристики; большое количество энергии высвобождается при разрыве связи между креатином и фосфатной молекулой. Двойная стрелка в реакции указывает на обратимость реакции.
Так как РСr имеет больше свободной энергии в гидролизе, чем АТФ, и его гидролиз катализируется ферментом креатинин-киназа. Клетки хранят приблизительно в 4-6 раз больше PCr, чем АТФ.
Преходящее увеличение АДФ при мышечном сокращении во время физической работы переключает креатининкиназу в направлении гидролиза PCr и образование АТФ. Реакция не требует кислорода и достигает максимальной энерегии за 10 секунд.
Если максимальное усилие длится более 10 секунд, то энергия для постоянной поддержки ресинтеза АТФ должна происходить из менее быстрого катаболизма.
Аденилат киназа представляет еще один путь катализируемой реакции регенерации АТФ. Реакция использует две молекулы АТФ для производства АТФ. 2 АДП --> АТФ+ФМФ
Так как РСr имеет больше свободной энергии в гидролизе, чем АТФ, и его гидролиз катализируется ферментом креатинин-киназа. Клетки хранят приблизительно в 4-6 раз больше PCr, чем АТФ.
Преходящее увеличение АДФ при мышечном сокращении во время физической работы переключает креатининкиназу в направлении гидролиза PCr и образование АТФ. Реакция не требует кислорода и достигает максимальной энерегии за 10 секунд.
Если максимальное усилие длится более 10 секунд, то энергия для постоянной поддержки ресинтеза АТФ должна происходить из менее быстрого катаболизма.
Аденилат киназа представляет еще один путь катализируемой реакции регенерации АТФ. Реакция использует две молекулы АТФ для производства АТФ. 2 АДП --> АТФ+ФМФ
Цикл лимонной кислоты
Биомедицинское значение
Цикл лимонной кислоты (цикл Кребса, цикл трикарбоновых кислты) представляет собой серию реакций, протекающих в митохондриях, которые окисляют ацетильные группы до СО2 и восстановление ферментов, которые реокисляются в дыхательной транспортной цепи.
Цикл лимонной кислоты - финальный путь для окисления углеводов, жиров и белков, так как глюкоза, жирные кислоты и большинство аминокилот метаболизируются до ацетил-СоА или промежуточных метаболитов цикла. Он также имеет большое значение в глюконеогенезе, липогенезе и обмене аминокислот. Эти процессы протекают во многих тканях, но печень - это единственный орган, где протекают все эти процессы со значительной степенью интенсивности. Поэтому последствия значительны, когда большое количество печеночных клеток повреждается, как при остром гепатите, или замещается соединительной тканью (как при циррозе). Несколько генетических дефектов приводящих к поражению ферментов цикла Кребса ассоциированы с тяжелым неврологическим повреждением, в результате очень значительного нарушения образования АТФ в центральной нервной системе.
Гипераммонемия, развивающаяся на прогрессированных стадиях заболевания печени, приводит к потере сознания , коме и судорогам, в результате нарушения работы цикла лимонной кислоты, приводящей с нижению продукции АТФ. Аммоний истощает метаболиты цикла, а также подавляет окислительное декарбоксилирование альфа-кетоглутарата.
Цикл лимонной кислоты - финальный путь для окисления углеводов, жиров и белков, так как глюкоза, жирные кислоты и большинство аминокилот метаболизируются до ацетил-СоА или промежуточных метаболитов цикла. Он также имеет большое значение в глюконеогенезе, липогенезе и обмене аминокислот. Эти процессы протекают во многих тканях, но печень - это единственный орган, где протекают все эти процессы со значительной степенью интенсивности. Поэтому последствия значительны, когда большое количество печеночных клеток повреждается, как при остром гепатите, или замещается соединительной тканью (как при циррозе). Несколько генетических дефектов приводящих к поражению ферментов цикла Кребса ассоциированы с тяжелым неврологическим повреждением, в результате очень значительного нарушения образования АТФ в центральной нервной системе.
Гипераммонемия, развивающаяся на прогрессированных стадиях заболевания печени, приводит к потере сознания , коме и судорогам, в результате нарушения работы цикла лимонной кислоты, приводящей с нижению продукции АТФ. Аммоний истощает метаболиты цикла, а также подавляет окислительное декарбоксилирование альфа-кетоглутарата.
Цикл лимонной кислоты обеспечивает субстратами респираторную цепь
Цикл начинается с реакции между ацетильной группой ацетил-СоА и 4-х углеродной дикарбоновой кислотой - щевалевоуксусной (оксалоацетатом), в результате образуется шестиуглеродная трикарбоновая кислота, называемая лимонной. В последующей серии реакцйи две молекулы СО2 высвобождаются и оксалоацетат регенирует. Только небольшое количество оксалоацетата необходимо для окисления большого количество ацетли-СоА; то его роль можно рассматривать, как каталитическую, и он регенирует к конце цикла.
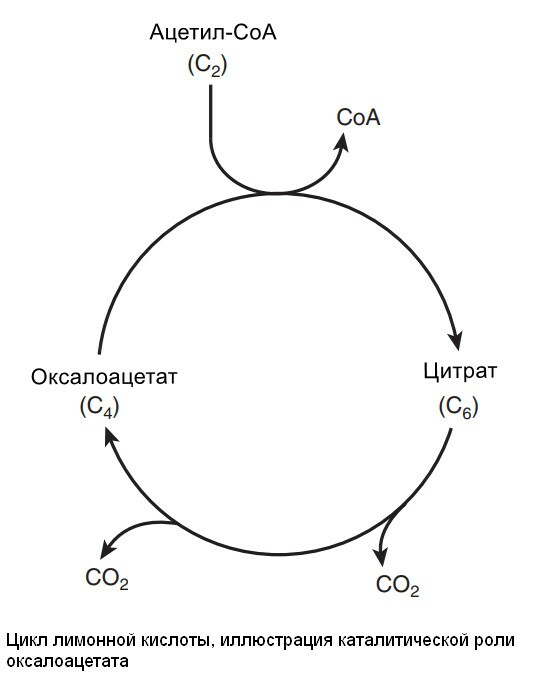
Цикл лимонной кислоты обеспечивает основной путь образования АФТ, связанный с окислением метаболического топлива. Во время окисления ацетил-СоA, коферменты восстанавливаются и потом окисляются в респираторной цепи, связанной с образованием АФТ (окислительное фосфорилирование).
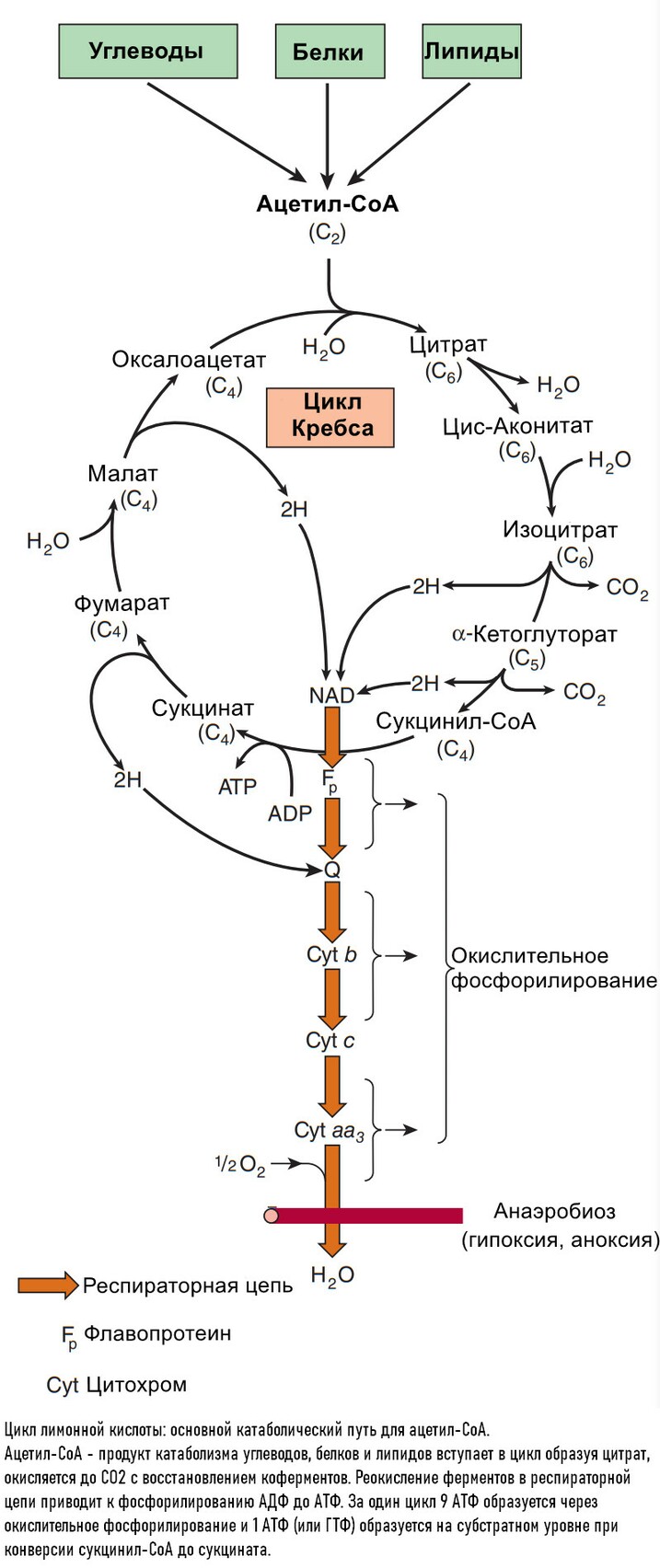
Этот процесс аэробный, требующий кислорода, как финального оксиданта в восстанавливающихся коферментов. Ферменты цикла Кребса локализованы в митохондриальном матриксе, где они находятся в свободном состоянии или прикреплены к внутренней митохондриальной мембране и складкам мембраны, где также обнаружены ферменты и коферменты респираторной цепи.
Митохондрия
Митохондрии - это внутриклеточные органеллы, которые часто называются электросанциями клетки. Формирование ацетил-Коэнзим-А, цикл Кребса, электронный транспорт и окислительное фосфорилирование - происходят в митохондриях.
Митохондрия состоит из наружной и внутренней мембран, последняя формирует складки, которые называются кристы. Серия ферментавных белковых комплексов, пронизивающих внутреннюю мембрану называется "комплекс мяча и стебеля", так как они выглядят, как мяч для гольфа на стройнике. Несмотря на то, что внутренняя мембрана имеет транспортную функцию, участки крист и особенно аппарат "мяч и стебель", специализируются как места, где происходит синтез АТФ.
Пространство между двумя мембранами называется - межмембранное пространство, а внутренняя часть митохондрии - матрикс. Матрикс наполнен гелеобразной сустанцией, состоящей из воды и белков. Метаболические ферменты и ДНК для репликации органелл хранятся здесь.
Митохондрии содержат собственную ДНК, и это означает, что они самореплицирующиеся. Когда необходимо произвести больше АФТ, митохондрия просто распадается на две половинки и затем вырастает до нормального размера.
Митохондрии располагаются там, где они больше всего необходимы. Внутри мышечной клетки они лежат непосредственно под клеточной мембраной (называются сакролемными или подсакролемными митохондриями) и между сокращающимися элементами (называются межфибриллярными митохондриями).
Митохондрия состоит из наружной и внутренней мембран, последняя формирует складки, которые называются кристы. Серия ферментавных белковых комплексов, пронизивающих внутреннюю мембрану называется "комплекс мяча и стебеля", так как они выглядят, как мяч для гольфа на стройнике. Несмотря на то, что внутренняя мембрана имеет транспортную функцию, участки крист и особенно аппарат "мяч и стебель", специализируются как места, где происходит синтез АТФ.
Пространство между двумя мембранами называется - межмембранное пространство, а внутренняя часть митохондрии - матрикс. Матрикс наполнен гелеобразной сустанцией, состоящей из воды и белков. Метаболические ферменты и ДНК для репликации органелл хранятся здесь.
Митохондрии содержат собственную ДНК, и это означает, что они самореплицирующиеся. Когда необходимо произвести больше АФТ, митохондрия просто распадается на две половинки и затем вырастает до нормального размера.
Митохондрии располагаются там, где они больше всего необходимы. Внутри мышечной клетки они лежат непосредственно под клеточной мембраной (называются сакролемными или подсакролемными митохондриями) и между сокращающимися элементами (называются межфибриллярными митохондриями).
Реакции цикла лимонной кислоты восстанавливают эквиваленты и CO2
Начальная реакция - конденсация ацетил-СоА и оксалоацитата, приводящая к образованию цитрата, катализируется конденсирующим ферментом, цитрат-синтетазой, при этом происходит образование связи углерод-углерод между метильным углеродом ацетил-СоА и карбонильным углеродом. После образования цитрил-СоА, следует гидролиз тиоэфирной связи, сопрождающийся потерей большого количества свободной энергии в форме теплоты; это определяет протекание реакции слева направо до ее завершения:

Превращение цитрата в изоцитрат катализируется аконитазой (аконитатгидразой), содержащей железо в Fe2+-состоянии.

Яд флурацетат, обнаруживаемый в некоторых растениях, употребление которых может быть фатальным для пасущихся животных. Он токсичен, потому что флуроцетил-СоА конденсируется с превращением оксалоацетата в флуроцистрат, который ингибирует аконитазу, вызывая накопление цитрата.
Изоцитрат проходит дегидрогенизацию, катализируемую изоцитратдегидрогеназой, в оразованием оксалосукцината.
Изоцитрат проходит дегидрогенизацию, катализируемую изоцитратдегидрогеназой, в оразованием оксалосукцината.
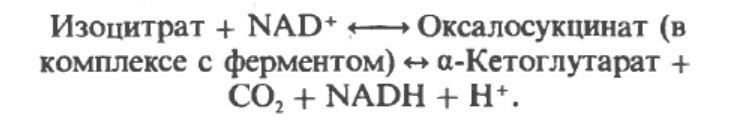
Важным компонентом реакции декароксилирования являются ионы марганца Mn2+ (или магния Mg2+).
α-Кетоглутарат подвергается окислительному декарбоксилированию, катализируемому α-кетоглутаратдегидрогеназным комплексом и требует участия кофакторов - тиаминдисульфата, липоата, NAD+, FAD и СоА; в результате образуется сукцинил-СоА - тиоэфир, содержащий высоэнергетическую связь.
α-Кетоглутарат подвергается окислительному декарбоксилированию, катализируемому α-кетоглутаратдегидрогеназным комплексом и требует участия кофакторов - тиаминдисульфата, липоата, NAD+, FAD и СоА; в результате образуется сукцинил-СоА - тиоэфир, содержащий высоэнергетическую связь.
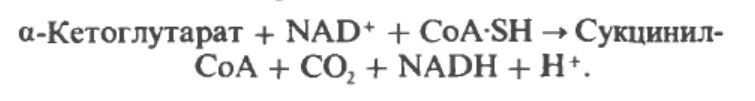
Реакция ингибируется асенатом, что приводит к накоплению субстрата (α-кетоглутарата).
Продолжением цикла является является превращение сукцинил-СоА в сукцинат, катализируемое сукцинаттиокиназой (сукцинил-СоА-синтетазой):
Продолжением цикла является является превращение сукцинил-СоА в сукцинат, катализируемое сукцинаттиокиназой (сукцинил-СоА-синтетазой):

Одним из субстратов является GDP (ГДФ) или IDP (ИДФ), из которого в присутствии неорганического фосфата образуется GTP (ITP). Это единственная стация цикла лимонной кислоты, в ходе которой генерируется высокоэнергетическая фосфатная связь на субстратном уровне. Сформированный GTP используется для декарбоксилирования оксалоацетата до фосфоэнолпирувата в глюконеогенезе и обеспечивает регуляторную связь между активностью цикла Кребса и оттягиванием оксалоацетата для глюконеогенеза.
Далее сукцинат дегидрогенируется, затем присоединяется молекула воды, и следует еще одна стадия дегидрогенирования, приводящая к регенерации оксалоацетета:
Далее сукцинат дегидрогенируется, затем присоединяется молекула воды, и следует еще одна стадия дегидрогенирования, приводящая к регенерации оксалоацетета:
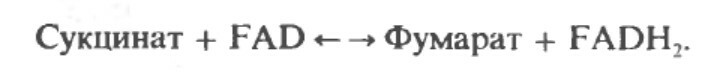
В результате дегидрогенирования образуется фумарат.
Фумараза (фумаратгидратаза) катализирует присоединение воды к фумарату с образованием малата.
Фумараза (фумаратгидратаза) катализирует присоединение воды к фумарату с образованием малата.
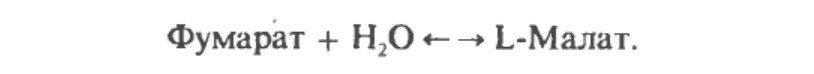
Малатдегдирогеназа катализирует превращение малата в оксалоацетат, реакция идет с участием NAD+.
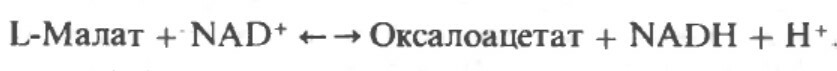
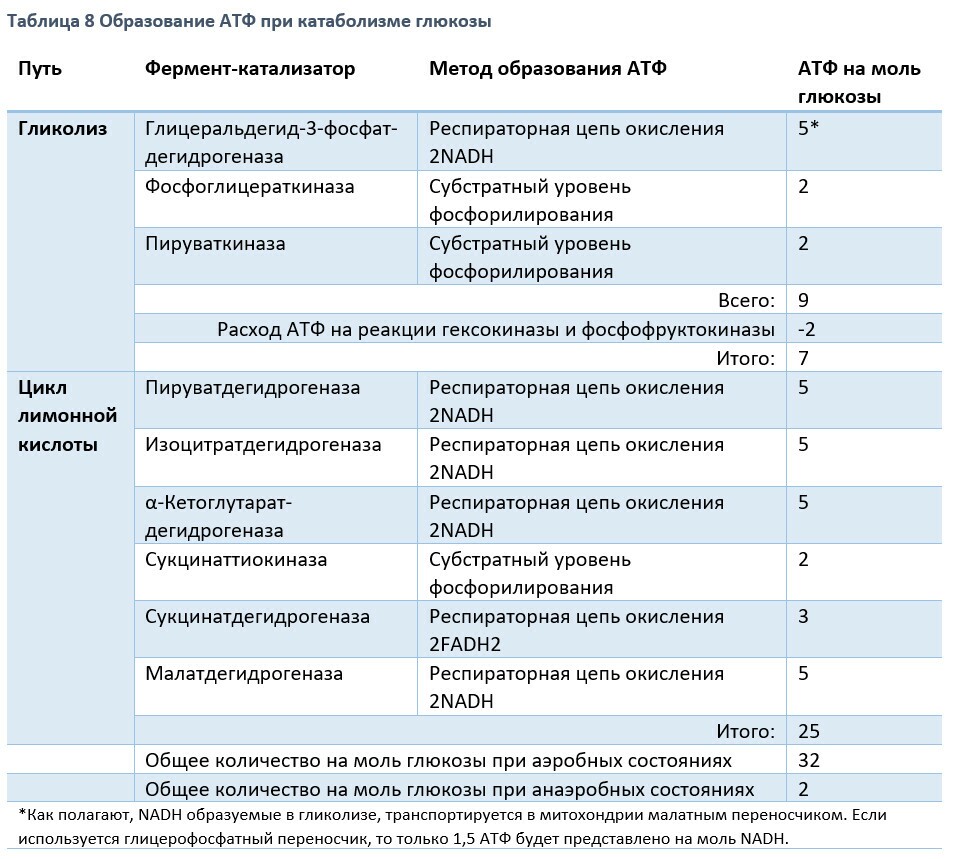
10 АТФ образуется за один цикл лимонной кислоты
В результате окисления, катализируемого дегидрогеназами цикла лимонной кислоты, три молекулы NADH и одна FADH2 образуется на каждую молекулу ацетил-СоА, в результате катаболизма за один цикл. Эти восстановительные эквиваленты передаются на дыхательную цепь внутренней мембраны митохондрий, где реокисляясь каждый NADH генерирует 2,5 АТФ, а FADH2 - 1,5 ATФ. И 1 АТФ (ГТФ) образуется на субстратном уровне, при превращении сукцинил-СоА в сукцинат катализируемом сукцинаттиокиназой.
Роль витаминов в цикле лимонной кислоты
Четыре водорастворимых витамин группы В необходимы для цикле лимонной кислоты:
1) Рибофлавин (В2), образует флавинадениндинуклаетид (FAD), который является кофактором для сукцинат-дегидрогиназы.
2) Ниацин (В3), входит в состав никотинамидадениндинуклеотида (NAD), который является коферментом (электронный акцептор) трех дегидрогеназ цикла: изоцитратдегидрогеназы, кетоглутаратдегидрогеназы и малатдегидрогеназы.
3) Тиамин (В1), входит в состав тиаминдифосфата, который является коферментом кетоглутаратдегидрогеназы.
4) Пантотеновая кислота (В5), входит в состав кофермента А, который является кофактором, связывающим "активные" ацильные остатки, например, в ацетил-СоА или сукцинил-СоА.
1) Рибофлавин (В2), образует флавинадениндинуклаетид (FAD), который является кофактором для сукцинат-дегидрогиназы.
2) Ниацин (В3), входит в состав никотинамидадениндинуклеотида (NAD), который является коферментом (электронный акцептор) трех дегидрогеназ цикла: изоцитратдегидрогеназы, кетоглутаратдегидрогеназы и малатдегидрогеназы.
3) Тиамин (В1), входит в состав тиаминдифосфата, который является коферментом кетоглутаратдегидрогеназы.
4) Пантотеновая кислота (В5), входит в состав кофермента А, который является кофактором, связывающим "активные" ацильные остатки, например, в ацетил-СоА или сукцинил-СоА.
Цикл лимонной кислоты играет ключевую роль в метаболизме
Цикл лимоной кислоты - это не только путь для окисления двух углеродных единиц, но также и основной путь взаимоконверсии метаболитов, производимых при переаминировании и дезаминировании аминокислот, и обеспечение сустратом для синтеза аминокислот при переаминировании, также как идля глюконеогенеза и синтеза жирных кислоты. Из-за этих функций, как в окислительных, так и синтетических процессах, роль цикла лимонной кислоты является амфиболической.
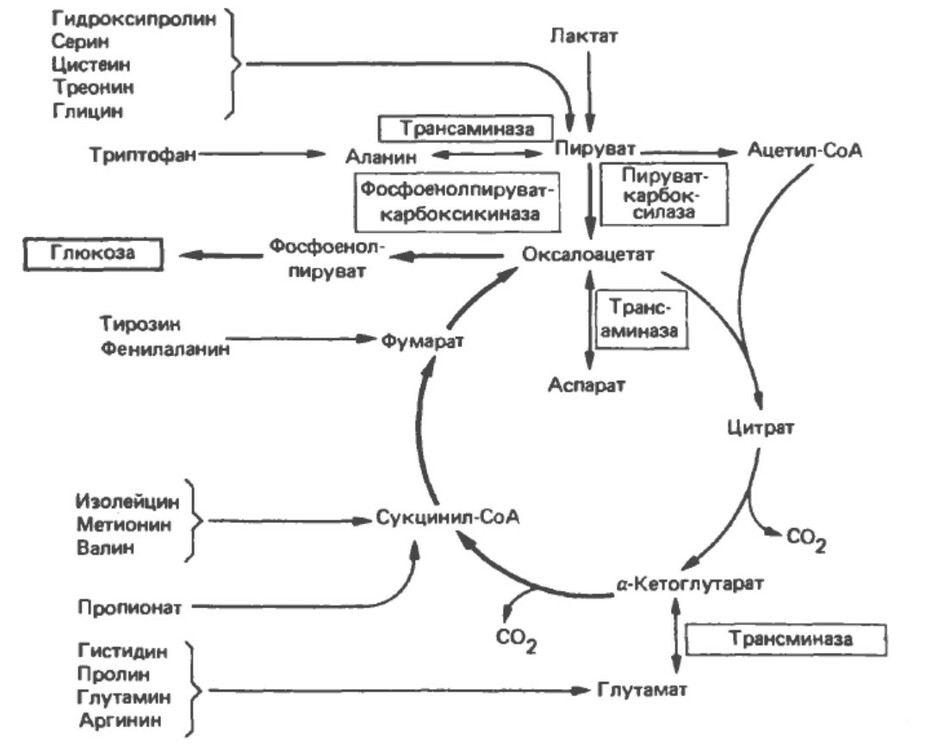
Глюконеогенез, переаминирование и дезаминирование
В промежуточные реагенты в цикле потенциальнно глюкогенны - так как из них может образовываться оксалоацетат, а значит и прозиводиться глюкоза (в печени и почках - органы, в которых происходит глюконеогенез).
Ключевой фермент, катализирующий переход из цикла Кребса в глюконеогенез является фосфоенолпируваткарбоксиканаза, которая катализирует декаброксилирование оксалоацетата (при участии GTP в качестве источника фосфата) с образованием фосфоенолпирувата:
Ключевой фермент, катализирующий переход из цикла Кребса в глюконеогенез является фосфоенолпируваткарбоксиканаза, которая катализирует декаброксилирование оксалоацетата (при участии GTP в качестве источника фосфата) с образованием фосфоенолпирувата:
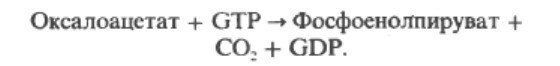
Одной из наиболее важных реакций является анаплеротическая реакция образования оксалоацетата путем карбоксилирования пиравата при участии фермента пируваткарбоксилазы.

В реакциях, катализируемых аминотрансферазами (трансаминазами), пируват образует из аланина, оксалоацетат - из аспартата и альфа-кетоглутарат - из глутамата. Так как эти реакции обратимы, цикл также может служить источником углеродного скелета для синтеза этих аминокислот. Например:
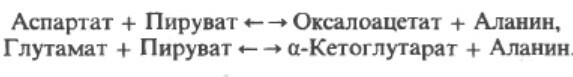
Синтез жирных кислот
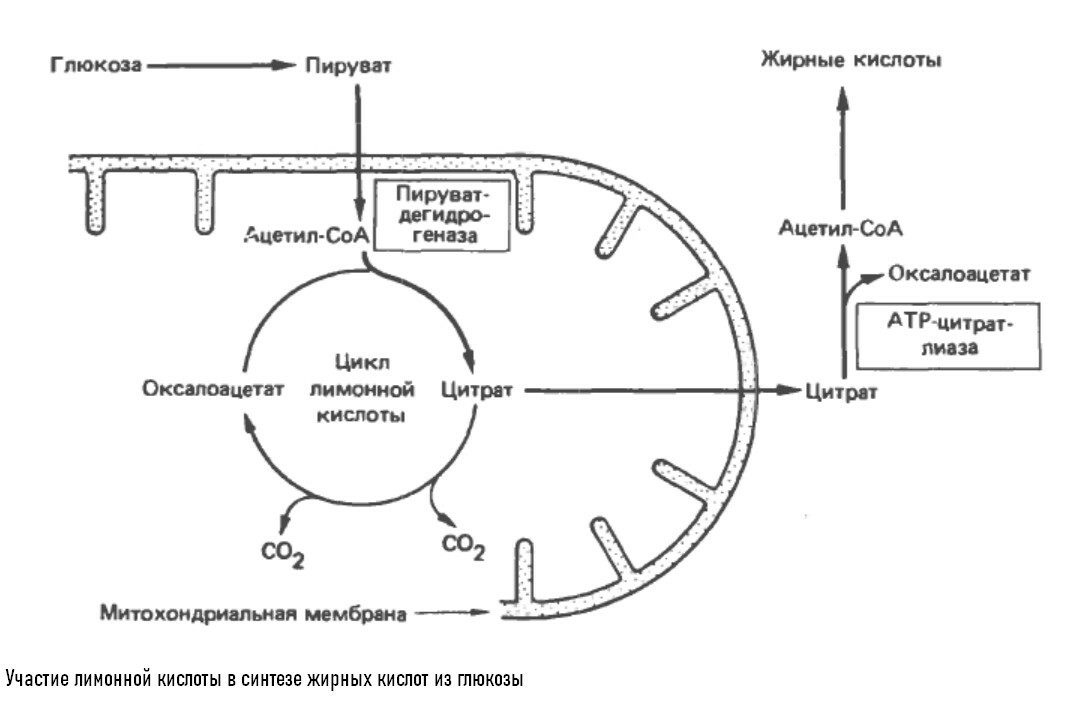
Ацетил-СоА, образующийся из пирувата при действии пируватдегдирогеназы, служит главным строительным белком при синтезе длинноцепочечных жирных кислот у млекопитающих. Пируватдегидрогеназа - митохондриальный фермент, а ферменты синтеза жирных кислот локализованы вне митохондрий, клетки должны осуществить транспорт ацетил-СоА через непроницаемую для него мемрану.
Ацетил-СоА в цикле Кребса образуется в цитрат, последний транспортируется из митохондрии и в цитозоле снова превращается в цетил-СоА, в результате реакции, катализируемой ферментом АТФ-цитратлиазой.
Ацетил-СоА в цикле Кребса образуется в цитрат, последний транспортируется из митохондрии и в цитозоле снова превращается в цетил-СоА, в результате реакции, катализируемой ферментом АТФ-цитратлиазой.
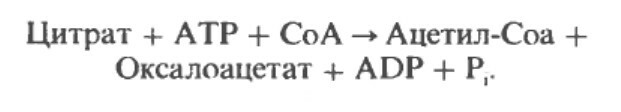
Гликолиз
Биомедицинское значение
Большинство тканей имеют минимальные потребности в глюкозе, тогда как потрености мозга и эритроцитов в ней весьма значительны, и при даже при пролонгированном голодании мозг может обеспечиться не более, чем на 20% от своей энергетической потребности из кетоновых телах.
Гликолиз - это главный путь утилизации глюкозы; он протекает во всех клетках. Это уникальный путь, поскольку он может использовать кислород, если последний доступен (аэробные условия), но может протекать и в отсутствии кислорода (анаэробные условия).
Эритроциты не имеют митохондрии, и полностью зависят от глюкозы, как метаболического топлива, и их метаболизм протекает в анэробном гликолизе.
Гликолиз это главный путь метаболизма углеводов. Способность его образовывать АТФ и в отстуствии кислорода особенно важна, потому что позволяет скелетным мышцам поддерживать очень высокий уровень активности даже когда окисление недостаточно эффективно и позволяет тканям переживать бескислородные эпизоды. Однако, сердечная мышца, адаптированная к аэробной работе, имеет достаточно низкую гликолитическую активность и плохо выживает в условиях ишемии. Заболевания, при которых наблюдается дефицит ферментов гликолиза (например, пируваткиназа) часто имеют картину гемолитической анемии, а если дефект касается скелетных мышц (например, фосфофруктокиназа) - то мышечная слабость. В быстро растущих раковых опухолях гликолиз протекает с высокой скоростью, вызвая накопления большого количества пирувата, который редуцируется до лактата, что повышает кислотность опухолевой ткани, что используется в терапии. Лактат используется для глюконеогенеза в печени, энергетически затратный процесс, который ответственен гиперметаболизм. Молочный ацитоз приводит к различным последствиям, включая нарушение активности пируватдегидрогеназы, особенно тиамина (витамин В1) дефицит.
Перевариваемые углеводы в тонком кишечнике расщепляются до дисахаридов, а далее — до моносахаридов. Всасывание моносахаров происходит путем облегченной диффузии и активного транспорта, что обеспечивает высокую их абсорбцию даже при низкой концентрации в кишечнике.
Метаболизм глюкозы в тканях начинается с образования глюкозо-6-фосфата, который, в отличие от свободной глюкозы, не способен покидать клетку. Дальнейшие превращения этого соединения идут в следующих направлениях:
— расщепление вновь до глюкозы в печени, почках и эпителии кишечника, что позволяет поддерживать постоянный уровень сахара в крови;
— синтез депонируемой формы глюкозы — гликогена — в печени, мышцах и почках;
— окисление по основному (аэробному) пути катаболизма;
— окисление по пути гликолиза (анаэробного катаболизма), обеспечивающего энергией интенсивно работающие (мышечная ткань) или лишенные митохондрий (эритроциты) ткани и клетки;
— по пентозофосфатному пути превращений, происходящему под действием коферментной формы витамина B1, в ходе которого генерируются продукты, используемые в синтезе биологически значимых молекул (НАДФ•Н2, нуклеиновых кислот).
Полный распад глюкозы и гликогена происходит в 4 шага представленные на рисунке ниже.
Гликолиз - это главный путь утилизации глюкозы; он протекает во всех клетках. Это уникальный путь, поскольку он может использовать кислород, если последний доступен (аэробные условия), но может протекать и в отсутствии кислорода (анаэробные условия).
Эритроциты не имеют митохондрии, и полностью зависят от глюкозы, как метаболического топлива, и их метаболизм протекает в анэробном гликолизе.
Гликолиз это главный путь метаболизма углеводов. Способность его образовывать АТФ и в отстуствии кислорода особенно важна, потому что позволяет скелетным мышцам поддерживать очень высокий уровень активности даже когда окисление недостаточно эффективно и позволяет тканям переживать бескислородные эпизоды. Однако, сердечная мышца, адаптированная к аэробной работе, имеет достаточно низкую гликолитическую активность и плохо выживает в условиях ишемии. Заболевания, при которых наблюдается дефицит ферментов гликолиза (например, пируваткиназа) часто имеют картину гемолитической анемии, а если дефект касается скелетных мышц (например, фосфофруктокиназа) - то мышечная слабость. В быстро растущих раковых опухолях гликолиз протекает с высокой скоростью, вызвая накопления большого количества пирувата, который редуцируется до лактата, что повышает кислотность опухолевой ткани, что используется в терапии. Лактат используется для глюконеогенеза в печени, энергетически затратный процесс, который ответственен гиперметаболизм. Молочный ацитоз приводит к различным последствиям, включая нарушение активности пируватдегидрогеназы, особенно тиамина (витамин В1) дефицит.
Перевариваемые углеводы в тонком кишечнике расщепляются до дисахаридов, а далее — до моносахаридов. Всасывание моносахаров происходит путем облегченной диффузии и активного транспорта, что обеспечивает высокую их абсорбцию даже при низкой концентрации в кишечнике.
Метаболизм глюкозы в тканях начинается с образования глюкозо-6-фосфата, который, в отличие от свободной глюкозы, не способен покидать клетку. Дальнейшие превращения этого соединения идут в следующих направлениях:
— расщепление вновь до глюкозы в печени, почках и эпителии кишечника, что позволяет поддерживать постоянный уровень сахара в крови;
— синтез депонируемой формы глюкозы — гликогена — в печени, мышцах и почках;
— окисление по основному (аэробному) пути катаболизма;
— окисление по пути гликолиза (анаэробного катаболизма), обеспечивающего энергией интенсивно работающие (мышечная ткань) или лишенные митохондрий (эритроциты) ткани и клетки;
— по пентозофосфатному пути превращений, происходящему под действием коферментной формы витамина B1, в ходе которого генерируются продукты, используемые в синтезе биологически значимых молекул (НАДФ•Н2, нуклеиновых кислот).
Полный распад глюкозы и гликогена происходит в 4 шага представленные на рисунке ниже.
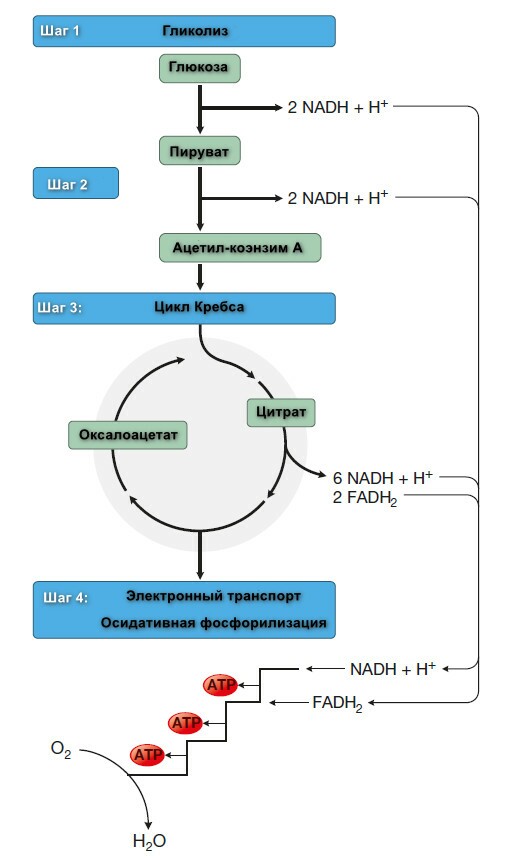
Шаг 1: Обзор гликолиза. Анаэробный гликолиз.
Гликолиз - буквально означает распад или расстворение сахара.
При изучении биохимических изменений в ходе мышечного сокращения было установлено, что при функционировании мышцы в анэробной среде проиходит исчезновение гликогена и появление пирувата и лактата в качестве главных конечных продуктов. Если затем обеспечить поступление кислорода, наблюдается "аэроное восстановление": образуется гликоген, и исчезают пируват и лактат. При работе мышцы в аэробных условиях накопление лактата не происходит, а пируват окисляется далее, превращаясь в СО2 и Н2О. На основании этого метаболизм углеводов делят на аэробную и анаэробную фазы.
При изучении биохимических изменений в ходе мышечного сокращения было установлено, что при функционировании мышцы в анэробной среде проиходит исчезновение гликогена и появление пирувата и лактата в качестве главных конечных продуктов. Если затем обеспечить поступление кислорода, наблюдается "аэроное восстановление": образуется гликоген, и исчезают пируват и лактат. При работе мышцы в аэробных условиях накопление лактата не происходит, а пируват окисляется далее, превращаясь в СО2 и Н2О. На основании этого метаболизм углеводов делят на аэробную и анаэробную фазы.
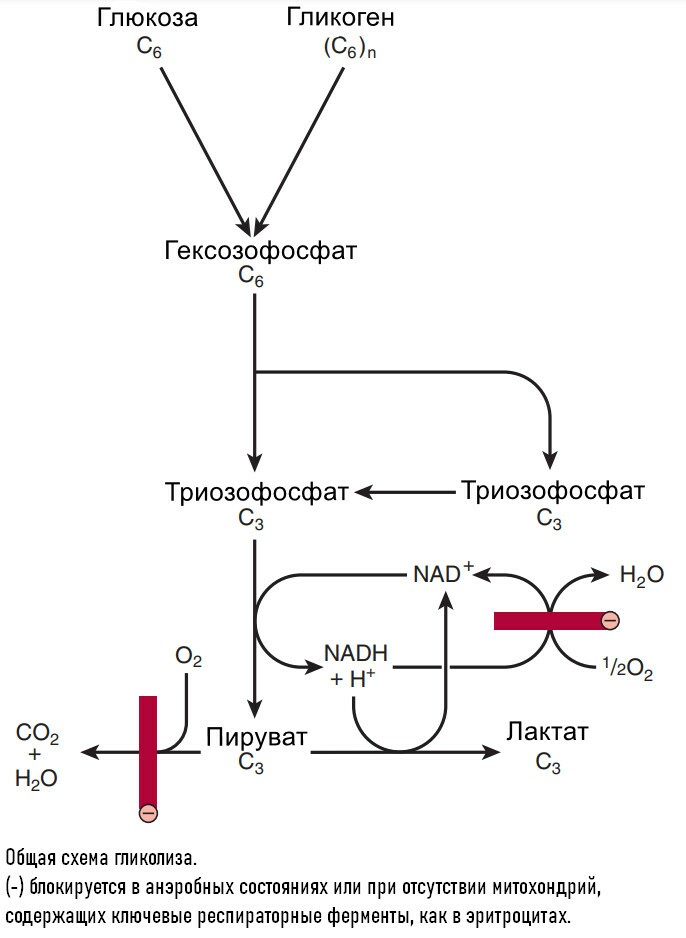
При недостатке кислорода, митохондриальное реокисление NADH, образуемого во время гликолиза, нарушается, и NADH реокисляется восстанавливая пируват до лактата, обеспечивая таким образом продолжение реакции гликолиза. Когда гликолиз протекает в анаэробных условиях, образуется мешьше АТФ на молекулу окисляемой глюкозы, таким образом больше глюкозы должно быть метаболизировано в анаэробных условиях, чем в аэробных.
Суммарное уравнение гликолиза, завершающееся образованием лактата, следующее:
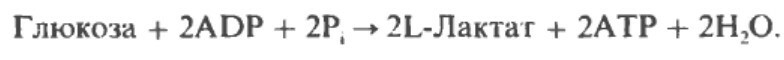
Энергетический путь гликолиза включат 10-11-стадий. Гликолиз начинается, как с глюкозы или гликогена и заканчивается продукцией как пирувата (пировиноградной кислоты) анаэробный гликолизом или лактата (молочная кислота) через аэробный гликолиз. Каждый шаг катализируется специфическими ферментами. Ферменты - это белки, ускоряющие скорость химической реакции без изменения самой реакции.
Как метаболический путь, гликолиз начинается с адсорбции глюкозы в кровоток из тонкого кишечника или высвобождения глюкозы в кровоток из печени. Каждый шаг сопровождается энергией. Затем глюкоза транспортируется в мышечную клетку путем облегченной диффузии, с использованием белков-переносчиков по градиенту контентрации. Белок называется глюкоз-транспортируемый протеин (GLUT). Транспорт пассивный процесс, не требует затрат энергии.
В основном транспорт глюкозы у человека в мышечной и сердечной мышце и жировой клетке происходит через GLUT-1 (не-инсулин-регулируемый) и GLUT-4 (инсулин-регулируемый) транспортеры.
Как метаболический путь, гликолиз начинается с адсорбции глюкозы в кровоток из тонкого кишечника или высвобождения глюкозы в кровоток из печени. Каждый шаг сопровождается энергией. Затем глюкоза транспортируется в мышечную клетку путем облегченной диффузии, с использованием белков-переносчиков по градиенту контентрации. Белок называется глюкоз-транспортируемый протеин (GLUT). Транспорт пассивный процесс, не требует затрат энергии.
В основном транспорт глюкозы у человека в мышечной и сердечной мышце и жировой клетке происходит через GLUT-1 (не-инсулин-регулируемый) и GLUT-4 (инсулин-регулируемый) транспортеры.
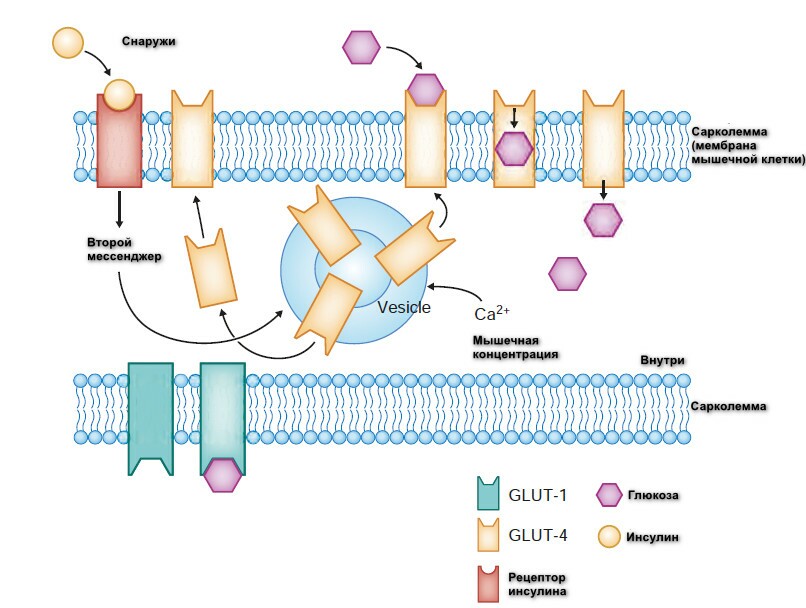
GLUT-1-транспортер располагается на сарколемме клеточной мембраны, в покоящейся мышце уровень глюкозы стабилен, и большинство глюкозы проходит через него. GLUT-4-транспортер активируется инсулином, через вторичную систему мессенджеров и сокращением мышц. Одним из таких транспортеров, полагают, является Ca2+. GLUT-4 располагается внутриклеточно в маленьких мешочках или везикулах внутри цитоплазмы. Когда они активированы, они буквально двигаются к клеточной поверхности и служат порталами для входа глюкозы в клетку.
Гликолиз происходит в цитоплазме клетки. Ферменты катализирующие каждый шаг, свободно плавают в цитоплазме. Гликолиз включает, как утилизацию, так и продукцию АТФ. Одна молекалу АТФ используется для первого шага в качестве энергии для метаболизма глюкозы, но не гликогена. Одна молекула АТФ используется в шаге 3 вне зависимости от того глюкоза или гликоген являются субстратом. Таким образом 1 АТФ используется для активации гликолиза гликогена и 2 АТФ - глюкозы.
Гликолиз происходит в цитоплазме клетки. Ферменты катализирующие каждый шаг, свободно плавают в цитоплазме. Гликолиз включает, как утилизацию, так и продукцию АТФ. Одна молекалу АТФ используется для первого шага в качестве энергии для метаболизма глюкозы, но не гликогена. Одна молекула АТФ используется в шаге 3 вне зависимости от того глюкоза или гликоген являются субстратом. Таким образом 1 АТФ используется для активации гликолиза гликогена и 2 АТФ - глюкозы.
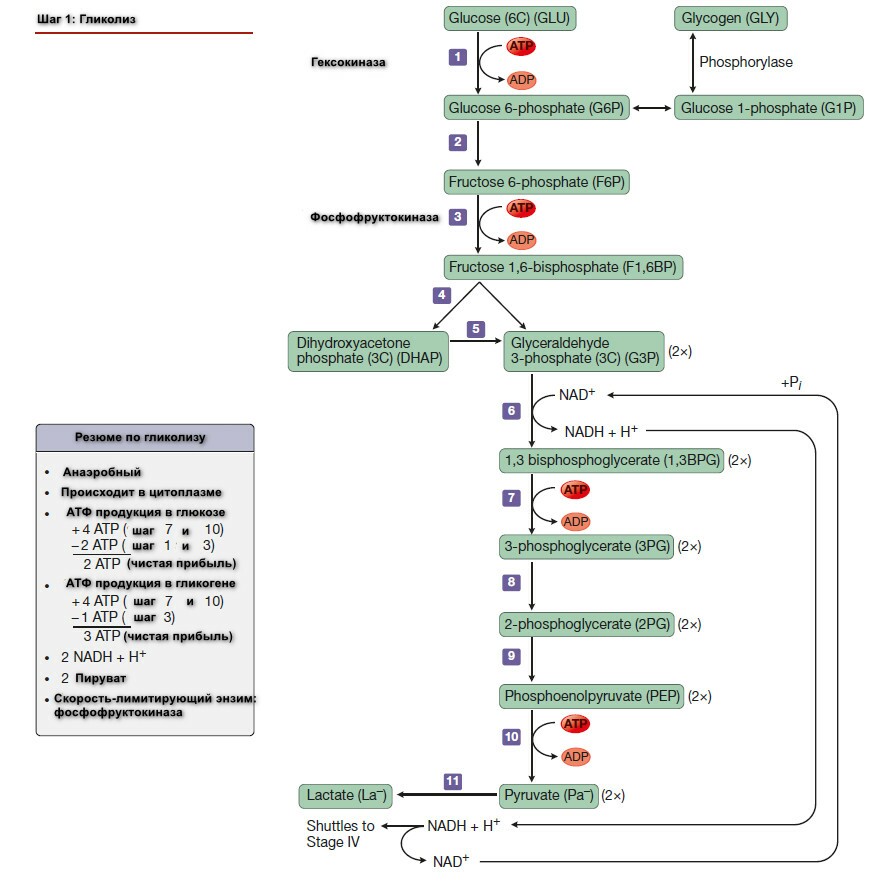
Субстратным фосфорилированием называется перенос Рi напрямую от фосфорилированного промежуточного соединения или субстрата на АДФ без какого-либо окисления
Процесс образования АТФ из АДФ+Ф в шагах 7 и 10 называется субстратным фосфорилированием. 3 АТФ вырабатывается, если начальным источником энергии является гликоген, и только 2 АТФ - если источником энергии является глюкоза.
Окисление-редукция (восстановление).
Существует три вида окисления: приобретение кислорода (поэтому и название такое), потеря водорода или прямая потеря электронов на атоме или веществе.
Процесс, при котором атом или вещество приобретает электроны, называется редукцией (восстановением). Отрицательный заряд электронов снижает общий молекулярный заряд. Доноры электронов известны, как агенты редукции, а акцепторы электронов - агенты оксидации. Основной донор электронов - органическое топливо, такое, как глюкоза. Кислород - финальный акцептор электронов или агент окисления в клеточном дыхании.
Когда один субстрат окисляется, другой одновременно редуцируется. Окисляемый субстракт таже теряет энергию, а редуцируемый субстрат приобретает энергию.
Окисление в форме удаления атомов водорода происходит в нескольких промежуточных шагах клеточного дыхания. Когда атом водорода теряется, он должен перенестись куда-то. Существует два важных водородных переносчика в клеточном дыхании - никотин-аденин-динуклеатит (НАД) и флавин-аденин-динуклеатид (ФАД). Оба НАД и ФАД могут принимать два электрона и два протона от двух атомов водорода. Целью НАД и ФАД служат транспортировка водорода. Они должны подхватывать водородные протоны (редуцироваться) и сбрасывать их (окисляться) другим молекулам без изменения, как самих переносчиков (НАД и ФАД) так и водородов.
Митохондрии называют "энергетическими фабриками", содержат молекулы-переносчики, которые удаляют электроны с водорода (окисление) и тутже переносят его на кислород (редукция). Синтез АТФ происходит во время реакции окисления-редукции (редокс-реакции).
Окисление-редукция (восстановление).
Существует три вида окисления: приобретение кислорода (поэтому и название такое), потеря водорода или прямая потеря электронов на атоме или веществе.
Процесс, при котором атом или вещество приобретает электроны, называется редукцией (восстановением). Отрицательный заряд электронов снижает общий молекулярный заряд. Доноры электронов известны, как агенты редукции, а акцепторы электронов - агенты оксидации. Основной донор электронов - органическое топливо, такое, как глюкоза. Кислород - финальный акцептор электронов или агент окисления в клеточном дыхании.
Когда один субстрат окисляется, другой одновременно редуцируется. Окисляемый субстракт таже теряет энергию, а редуцируемый субстрат приобретает энергию.
Окисление в форме удаления атомов водорода происходит в нескольких промежуточных шагах клеточного дыхания. Когда атом водорода теряется, он должен перенестись куда-то. Существует два важных водородных переносчика в клеточном дыхании - никотин-аденин-динуклеатит (НАД) и флавин-аденин-динуклеатид (ФАД). Оба НАД и ФАД могут принимать два электрона и два протона от двух атомов водорода. Целью НАД и ФАД служат транспортировка водорода. Они должны подхватывать водородные протоны (редуцироваться) и сбрасывать их (окисляться) другим молекулам без изменения, как самих переносчиков (НАД и ФАД) так и водородов.
Митохондрии называют "энергетическими фабриками", содержат молекулы-переносчики, которые удаляют электроны с водорода (окисление) и тутже переносят его на кислород (редукция). Синтез АТФ происходит во время реакции окисления-редукции (редокс-реакции).

Рисунок выше иллюстрирует общую схему для окисления водорода, сопровождающееся транспортом электрона на кислород. Во время клеточного окисления, атомы водорода не просто растворяются во внеклеточной жидкости. Субстрат-специфические дегидрогеназные ферменты катализируют высвобождение водорода из субстрата пищевого вещества. Коэнзимный компонент дегидрогеназы (обычно ниацин-содержащий никотинамид-аденин динуклеатид (НАД+), принимает пары электронов (энергию) от водорода. Хотя субстрат окисляется и отдает водороды (электроны), НАД+ приобретает углероды и два электрона и редуцирует НАДН. Рибофлавин-содержащий коэнзим, флавин-аденин динуаклеатид (ФАД) служит, как другой акцептор электронов, чтобы окислять фрагменты пищи. Как и NAD+, FAD катализируются во время дегидратации и принимает пары электронов. В отличие НАД+, ФАД становится ФАДН2, принимая оба водорода. НАД и ФАДН2 обеспечивают энерегетически-богатые молекулы, потому что они несут электроны с высоко-энергетическим потенциалом.
Цитохромы - это серия металл-содержащих белков-переносчиков распределены на внутренней мембране митохондрий, и передают пары электронов, несомые НАДН и АФДН2. Металлическая порция каждого цитохрома существует также в окисленном или редуцированном состоянии (для железа Fe3+ или Fe2+). Принимая электрон, металлическая часть специфического цитохрома редуцирует его железистую форму. В свою очередь ион железа отдает электрон следующему цитохрому и так по цепи. Перекулючаясь между этими двумя формами железа, цитохромы передают электроны редуцируя кислород до формы воды.
Электрон-транспортая система специфических молекул формирует дыхательную (или цитохромную) цепь, в конце которой электроны, забранные у водорода передуются кислороду. На каждую пару атомов водорода, два электрона спускаются по пути и редуцируют один атом кислорода с формированием одной молекулы воды. Во время пассажа электронов по 5-цитохромной цепи, высвобождается достаточно энергеии, чтобы фосфорилировать АДФ до АТФ в трех местах. Только на последнем цитохроме цитохром-оксидаза (цитохром аа2, с сильной аффинностью к кислороду), разряжается, разряжает свои электроны напрямую на кислород.
Цитохромы - это серия металл-содержащих белков-переносчиков распределены на внутренней мембране митохондрий, и передают пары электронов, несомые НАДН и АФДН2. Металлическая порция каждого цитохрома существует также в окисленном или редуцированном состоянии (для железа Fe3+ или Fe2+). Принимая электрон, металлическая часть специфического цитохрома редуцирует его железистую форму. В свою очередь ион железа отдает электрон следующему цитохрому и так по цепи. Перекулючаясь между этими двумя формами железа, цитохромы передают электроны редуцируя кислород до формы воды.
Электрон-транспортая система специфических молекул формирует дыхательную (или цитохромную) цепь, в конце которой электроны, забранные у водорода передуются кислороду. На каждую пару атомов водорода, два электрона спускаются по пути и редуцируют один атом кислорода с формированием одной молекулы воды. Во время пассажа электронов по 5-цитохромной цепи, высвобождается достаточно энергеии, чтобы фосфорилировать АДФ до АТФ в трех местах. Только на последнем цитохроме цитохром-оксидаза (цитохром аа2, с сильной аффинностью к кислороду), разряжается, разряжает свои электроны напрямую на кислород.
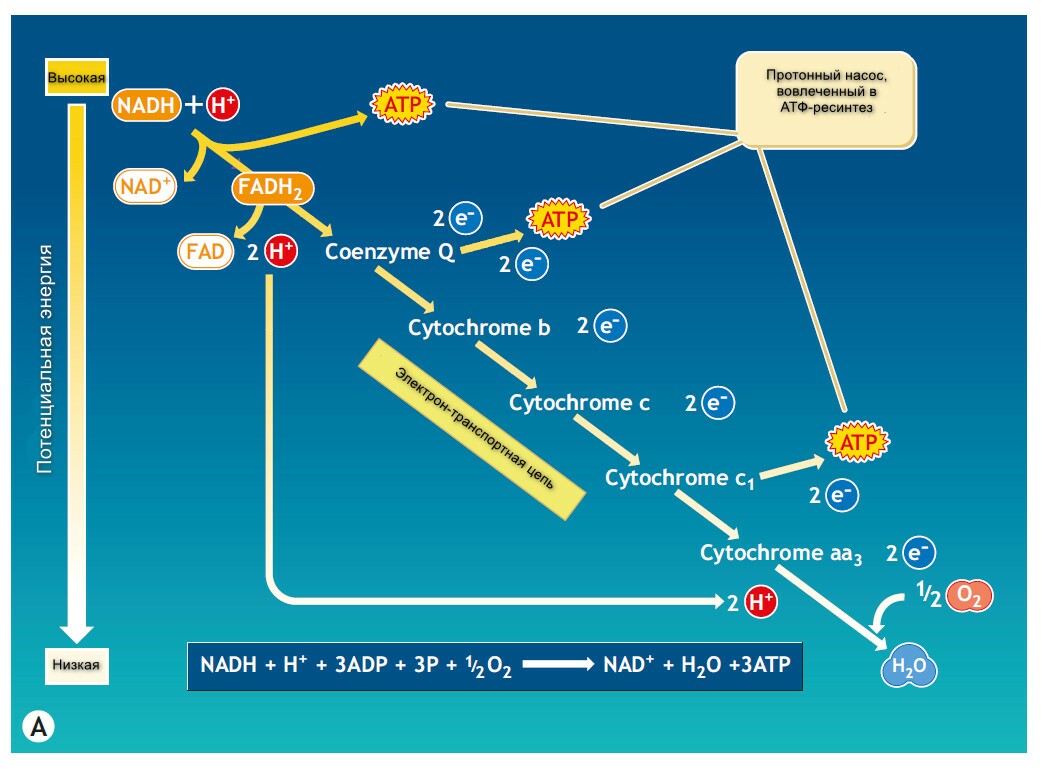
Рис3: Примеры использования потенциальной энергии. А - В организме, где электрон-транспортная цепь забирает электроны с водородов и передает непосредственно на кислород. В окислительно-восстановительной (редукционной) реакции, значительное количество энергии накапливается между атомами водорода, и не переходит в кинетическую энергию, но переводится в АТФ, В. - В промышленности, энергии от падения воды становится заряженной, чтобы перевернуть водное колесо, энергия которой представляет собой механическую работу.
На рисунке выше показано окисление водорода, транспорт электрона и передача энергии в дыхательной цепи, в относительно небольшое количество. Каждый электронный акцептор дыхательного пути имеет прогрессивно большую аффинность для электронов. В биохимии, эта аффинность для электронов представленная на субстрате, называется редукционным потенциалом. Кислород, последний, кто получает в цепи электроны, имеет наибольшый редукционный потенциал.
Этапы Шага 1
Все ферменты гликолитического пути находятся во внемитохондиральной растворимой клеточной фрактции (цитозоле). Они катализируют реакции превращения глюкозы в пируват и лактат, которые протиекаются в следующей последовательности.
Этап 1 . Молекула глюкозы фосфорилируется путем переноса фосфатной группы от АТФ на один из 6 углеродов глюкозы, образуя глюкозо-6-фосфат. Гексогиназа - фермент, который катализирует этот процесс. Эта фосфорилизация эффективно ловит молекулу глюкозы в клетке, так как электрический заряд фосфатной группы не позволяет ей пересекать мембрану, а фермент, который мог бы разрушить эту связь не имеется в мышечной клетке.
Так же происходит и с гликогеном в клетке, который оказывается в ловушке той клетки, где он откладывается ферментом глюкокиназой. Но, с другой стороны, в печени есть ферменты (фосфатаза), которые разрушают гликоген и высвобождают глюкозу в кровяной поток. Функция глюкокинзы служит в "захватывании" глокозы из кровотока после приема пищи (когда концентрация глюкозы в крови повышается).
Эти моменты важны, так как во время высоко-интенсивной длительной нагрузки, гликоген отложенный в специфических мышцах, должен использоваться там. Более того, гликоген, отложенный в мышцах, не используемых во время физической активности (например, мышцы верхней части тела, во время бега) не может быть транспортирован из неактивных мышц в активные. Вот почему, высокий уровень гликогена должен быть отложен мышцах, каторые будут использоваться.
Этап 1 . Молекула глюкозы фосфорилируется путем переноса фосфатной группы от АТФ на один из 6 углеродов глюкозы, образуя глюкозо-6-фосфат. Гексогиназа - фермент, который катализирует этот процесс. Эта фосфорилизация эффективно ловит молекулу глюкозы в клетке, так как электрический заряд фосфатной группы не позволяет ей пересекать мембрану, а фермент, который мог бы разрушить эту связь не имеется в мышечной клетке.
Так же происходит и с гликогеном в клетке, который оказывается в ловушке той клетки, где он откладывается ферментом глюкокиназой. Но, с другой стороны, в печени есть ферменты (фосфатаза), которые разрушают гликоген и высвобождают глюкозу в кровяной поток. Функция глюкокинзы служит в "захватывании" глокозы из кровотока после приема пищи (когда концентрация глюкозы в крови повышается).
Эти моменты важны, так как во время высоко-интенсивной длительной нагрузки, гликоген отложенный в специфических мышцах, должен использоваться там. Более того, гликоген, отложенный в мышцах, не используемых во время физической активности (например, мышцы верхней части тела, во время бега) не может быть транспортирован из неактивных мышц в активные. Вот почему, высокий уровень гликогена должен быть отложен мышцах, каторые будут использоваться.
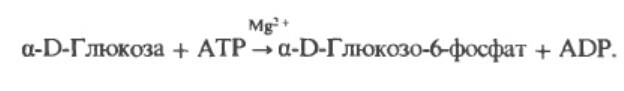
Этап 2. Атомы глюкозы-6-фосфата реорганизуются в форму фруктоза-6-фосфат, при участии фосфогексозоизомеразы.
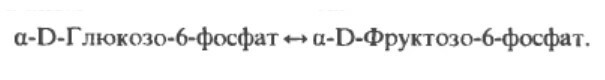
Этап 3. Другая молекула АТФ распадается и фосфат добавляется к первому углероду. Это дополнение фосфатной группы размещает в итоге фосфты с каждого конца молекулы, приводя к образованию фруктозы-1,6-бифосфат. Два фосфата теперь на молекуле. Этот этап катализируется ферментом фосфофруктокиназа (ФФК, PFK), который является скорость-лимитирующим ферментом в гликолизе.

Этап 4. На этом шаге 6-углеродный сахар распадается под действием альдолазы (фруктозо-1.6-бифосфат-альдолазой) на два 3-х углеродных сахара, обозначемых 3С. Они идентичны по их атомному составу, но имеются разные имена (дигидроацетонфосфат или ДАФ (DHAP) и глицеральдегид-3-фосфат Г3Ф (G3P), так как атомы организованы в молекулах по-разному.
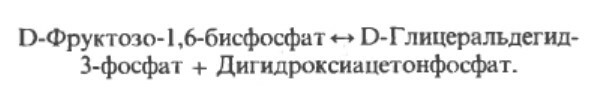
Этап 5. Атомы дигидроацетонафосфата перестраиваются при участии фермента фосфотриозоизомераза в глицеральдегид-3-фосффат, в котором фосфатная группа на 3-м углероде. Вот почему с этого этапа у на схеме выше у нас реакции дальше теперь будут удваиваться.
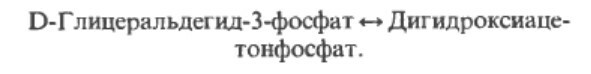
Шаг 6. Два процесса происходят на этом этапе. Первый - пара водородных атомов переноситься с GТP на переносчик НАД+, редуцируя его до НАД+Н+. Судьба HAД+Н+ будет решаться позднее. Эта реакция высвобождает достаточно энергии, чтобы провести вторую реакцию, в которой на дигидроксиацетонфосфат при участии фермента фосфотриозоизомеразы добавляется фосфат из пула фосфата, который всегда имеется в цитоплазме, на первый углерод. Таким образом формируется 1,3-бифосфоглицерат (1.3 BPG), проходя через стадию образования глицеральдегид-3-фосфата:
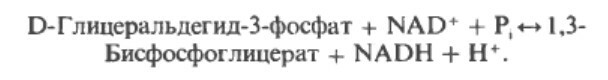
Фермент, катализирующий эту реакция - NAD-зависимая глицеральдегид-3-фосфатдегдирогеназа, содержащая четры SH-группы.Реакция завершается фосфорилированием тиоэфирной связи с присоединением неорганического фосфата Рi; при этом образуется 1.3-бифосфоглицерат и свободный фермент с -SH-группой. Потенциальная энергия процесса окисленияя резервуется санаыал в высокоэнергетической тиоэфирной связи, а после фосфоролиза - в всокоэнергтической фосфатной связи 1.3-бифосфоглицерата.
Шаг 7. Высокоэнергтический фосфат переходит далее в состав АТФ при участии фермента фосфоглицераткиназы. АТФ наконец образуется из АДФ на этом этапе, когда фосфат с первого углерода переносится на АДФ, накапливая энергию. Так как этот шаг также удвоен, то накапливается 2АТФ молекулы.
Шаг 7. Высокоэнергтический фосфат переходит далее в состав АТФ при участии фермента фосфоглицераткиназы. АТФ наконец образуется из АДФ на этом этапе, когда фосфат с первого углерода переносится на АДФ, накапливая энергию. Так как этот шаг также удвоен, то накапливается 2АТФ молекулы.
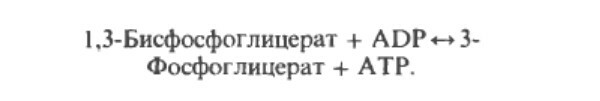
Здесь мы имеем пример фосфорилирования "на субстратном уровне".
Шаг 8. Здесь просто происходит перестройка молекулы, где фосфат перемещается с 3 на 2 углерод и 3-фосфоглицерат превращается в 2-фосфоглицерат при участии фермента фосфоглицератмутазы.
Шаг 8. Здесь просто происходит перестройка молекулы, где фосфат перемещается с 3 на 2 углерод и 3-фосфоглицерат превращается в 2-фосфоглицерат при участии фермента фосфоглицератмутазы.
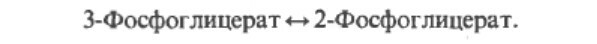
Шаг 9. Молекула воды удаляется ферментом енолазой, что приводит к ослаблению связи между оставшимися фосфатными группами и остальными атомами, при этом фосфат в положении 2 переходит в высокоэнергетическое состояние; продуктом реакции является фосфоенолпируват. Енолаза ингибируется ионами фторида; эти пользуются, когда необходимо остановить гликолиз. Енолаза нуждается в ионах Mg2+ или Mn2+:
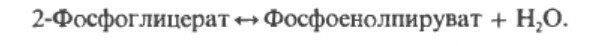
Шаг 10. Оставшийся фосфат переносится с фосфоэнолпирувата (ФЭП, PEP) на AДФ, формируя пируват и АТФ. Фермент, который катализирует этот шаг - пируваткиназа. И так как эта реакция удваивается, мы опять получает 2АТФ. Эта реакция является физиологически необратимой.
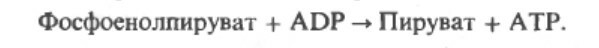
Шаг 11. В анаэробных условиях, атомы водорода на НАД+Н+ не способны войти в электронную транспортную цепь, они переносятся на пируват (пировиноградную кислоту), формируя лактат (молочную кислоту), что регенерирует НАД+Н. Ферментом, которым катализуруется эта реакция является лактатдегидрогеназа.
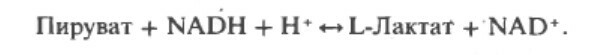
Реокисление NADH путем образования лактата обеспечивает возможность протекания гликолиза в отсутствии кислорода, поскольку поставляется NAD+, необходимый для глицеральдегид-3-фосфатгедирогеназной реакции. Таким образом, в тканях, функционирующих в условиях гипоксии, наблюдается образование лактата. Образовавшийся лактат может быть обнаружен в тканях, крови и моче. Гликолиз в эритроцитах даже в аэробных условиях всегда завершается образованием лактата, так как в этих клетках отсуствуют митохондрии, содержащие ферментные системы аэробного окисления пирувата. Печень, почки и сердце обычно утилизируют лактат, но в условиях гипоксии образуют его.
Формула пирвата С3Н3О3, формула лактата С3Н5О3. Формула пировиноградной кислоты С3Н4О3, а молочной кислоты С3Н6О3. У обоих число молекул углерода и кислорода одинаково; однако 2 молекулы пирувата/пировиноградной кислоты содержит на 4 молекулы водорода меньше, чем 2 молекулы лактата/молочной кислоты. Это те самые молекулы водорода, которые переносятся НАД+ в шаге 6 и используются для образования лактата из пирувата. Если лактат/молочная кислота не образуется, атомы водорода из шага 6 могут быть перенесены дальше вниз по метаболической цепочке.
Процесс гликолиза, заканчивающийся образованием пирувата/пировиноградной кислоты, называется аэробным гликолизом (или медленным гликолизом). Процесс гликолиза, заканчивающийся образованием лактата/молочной кислоты, называется анаэробным гликолизом (или быстрым гликолизом).
Глюкоза является, в основном, топливом для медленного гликолиза, тогда как гликоген - для быстрого гликолиза.
Формула пирвата С3Н3О3, формула лактата С3Н5О3. Формула пировиноградной кислоты С3Н4О3, а молочной кислоты С3Н6О3. У обоих число молекул углерода и кислорода одинаково; однако 2 молекулы пирувата/пировиноградной кислоты содержит на 4 молекулы водорода меньше, чем 2 молекулы лактата/молочной кислоты. Это те самые молекулы водорода, которые переносятся НАД+ в шаге 6 и используются для образования лактата из пирувата. Если лактат/молочная кислота не образуется, атомы водорода из шага 6 могут быть перенесены дальше вниз по метаболической цепочке.
Процесс гликолиза, заканчивающийся образованием пирувата/пировиноградной кислоты, называется аэробным гликолизом (или медленным гликолизом). Процесс гликолиза, заканчивающийся образованием лактата/молочной кислоты, называется анаэробным гликолизом (или быстрым гликолизом).
Глюкоза является, в основном, топливом для медленного гликолиза, тогда как гликоген - для быстрого гликолиза.
О лактате
Во время интенсивных нагрузок, респираторная цепь не может присоединить атомы водорода на NADH. Продолжающееся высвободение анаэробной энерегии в гликолизе требует доступность NAD+ для окисления 3-фосфоглицеральдлегида, однако высокая скорость гликолиза замедляется и останавливается. Во время быстрого анаэробного гликолиза NAD+ высвобождает неокисленные атомы водорода, связанные с пируватом для формирования лактата. Образование лактата требует дополнительного шага, катализируемого лактатдегидрогеназой, этот шаг является обратимой реакцией.
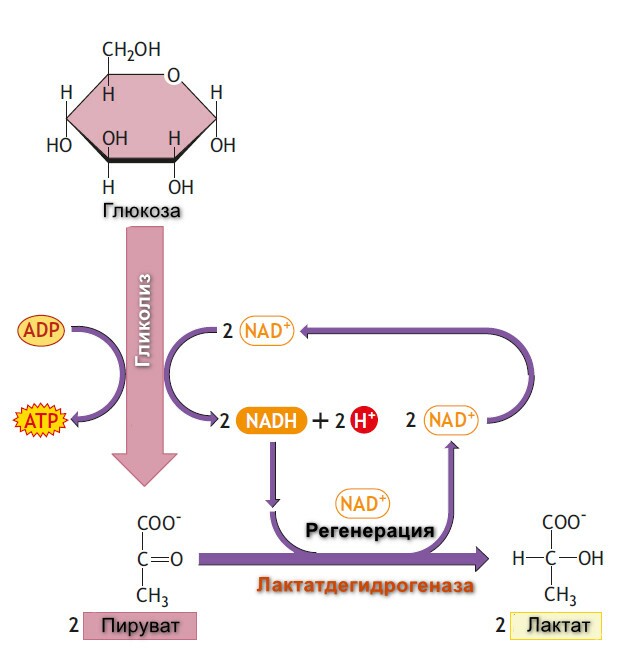
Во время покоя или умеренных физических нагрузок, лактат формирует два путя метаболизма:
1 - энергетический метаболизм эритроцитов, которые не содержат митохондрий;
2 - ограничения, установленные ферментативной активностью мышечных волокон с высокой гликолитической способностью.
Любой лактат, который образуется таким образом готов для окисления для снабжения энергией соседние мышечные волокна с высокой окислительной способностью или более дальные такни, такие, как сердце и дыхательные мышцы. Лактат может быть также непрямым предшественником гликогена в печени. Однако, лактат не накапливается, так как его скорость удаления равна скорости образования.
Непрямой путь, в котором лактат участвует в печеночном синтезе гликогена (особенно после еды), называется "глюкозным парадоксом". Лактат образуется в мышечной ткани, и затем диффундирует в интерстициальное пространство и кровоток для удаления из энергетического метаболизма или обеспечивает гликонеогенетической субстрат для синтеза гликогена. Этот путь для экстраэнерегии остается временным, если кровяный и мышечный лактат увеличивается, АТФ-образование не успевает за его использованием. Усталость наступает и качество выполнения упражнений снижается. Увеличение внутриклеточной кислотности при анэробном состоянии ведет к усталости и инактивации различных ферментов в передаче энергии и ухудшает мышечные сократительные свойства.
Лактат не должен рассматриваться как побочный продукт метаболизма. Наоборот, он обеспечивает важный источник химической энергии, которая накапливается при интенсивных упражнения. Когда снабжение кислорода становится доступным во время восстановления и отдыха, или уровень упражнений замедляется, NAD+ собирает водороды, прикрепленные к лактату и формирует АТФ через окисление. Углеродный скелет пируватной молекулы преобразуется в лактат во время упражнений (одна молекула пирувата + 2 Н образуют молекулу лактата), и становится также окисленным для энерегии или синтезируется в глюкозу (глюконеогенез) в мышечной ткани или в цикле Кори.
1 - энергетический метаболизм эритроцитов, которые не содержат митохондрий;
2 - ограничения, установленные ферментативной активностью мышечных волокон с высокой гликолитической способностью.
Любой лактат, который образуется таким образом готов для окисления для снабжения энергией соседние мышечные волокна с высокой окислительной способностью или более дальные такни, такие, как сердце и дыхательные мышцы. Лактат может быть также непрямым предшественником гликогена в печени. Однако, лактат не накапливается, так как его скорость удаления равна скорости образования.
Непрямой путь, в котором лактат участвует в печеночном синтезе гликогена (особенно после еды), называется "глюкозным парадоксом". Лактат образуется в мышечной ткани, и затем диффундирует в интерстициальное пространство и кровоток для удаления из энергетического метаболизма или обеспечивает гликонеогенетической субстрат для синтеза гликогена. Этот путь для экстраэнерегии остается временным, если кровяный и мышечный лактат увеличивается, АТФ-образование не успевает за его использованием. Усталость наступает и качество выполнения упражнений снижается. Увеличение внутриклеточной кислотности при анэробном состоянии ведет к усталости и инактивации различных ферментов в передаче энергии и ухудшает мышечные сократительные свойства.
Лактат не должен рассматриваться как побочный продукт метаболизма. Наоборот, он обеспечивает важный источник химической энергии, которая накапливается при интенсивных упражнения. Когда снабжение кислорода становится доступным во время восстановления и отдыха, или уровень упражнений замедляется, NAD+ собирает водороды, прикрепленные к лактату и формирует АТФ через окисление. Углеродный скелет пируватной молекулы преобразуется в лактат во время упражнений (одна молекула пирувата + 2 Н образуют молекулу лактата), и становится также окисленным для энерегии или синтезируется в глюкозу (глюконеогенез) в мышечной ткани или в цикле Кори.
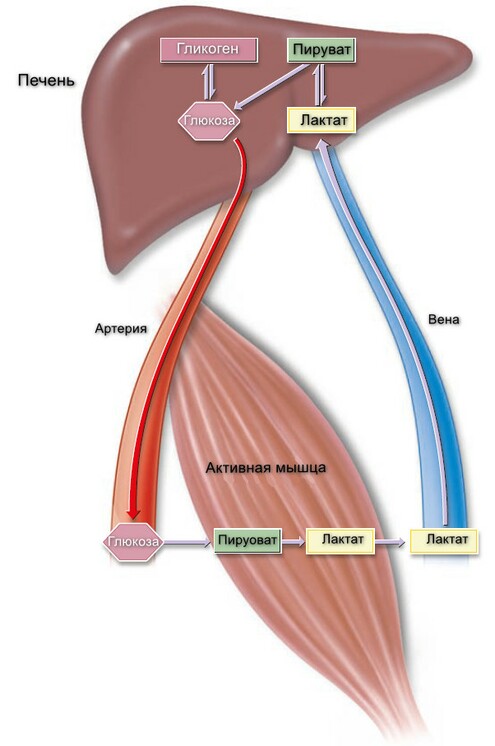
Цикл Кори (рисунок выше), удаляет лактат и также используется для пополнения запасов гликогена, сниженных во время интенсивной нагрузки.
Во время интенсивной нагрузки ( более 80% аэробных возможностей) с повышенным углеводным катаболизмом, гликоген внутри неактивных тканей обеспечивает потребности активных мышц. Аткивный гликоген преобразуется через обменный лактатный пул, так как неактивные мышцы высвобождают лактат в циркуляцию. Лактат обеспечивает предшественников синтезировать углеводы (через цикл Кори в печени и почках), чтобы поддержать уровень глюкозы в крови и потребности в энерегии во время упражнений.
Этот процесс переноса лактата между клетками делает возможны гликогенолиз в клетках для снабжения энергией других клеток в процессе окисления. Это делает мышечную ткань не только основным местом продукции лактата, но также первичной тканью для его удаления во время окисления.
Во время интенсивной нагрузки ( более 80% аэробных возможностей) с повышенным углеводным катаболизмом, гликоген внутри неактивных тканей обеспечивает потребности активных мышц. Аткивный гликоген преобразуется через обменный лактатный пул, так как неактивные мышцы высвобождают лактат в циркуляцию. Лактат обеспечивает предшественников синтезировать углеводы (через цикл Кори в печени и почках), чтобы поддержать уровень глюкозы в крови и потребности в энерегии во время упражнений.
Этот процесс переноса лактата между клетками делает возможны гликогенолиз в клетках для снабжения энергией других клеток в процессе окисления. Это делает мышечную ткань не только основным местом продукции лактата, но также первичной тканью для его удаления во время окисления.
Шаг II: образование ацетил-коэнзима-А
Шаг II - очень кротокий метаболический путь, состоящий из медленной конверсии пирувата в ацетил-конэнзим-А. Ни АТФ, ни какой-либо другой продукт здесь не используется или не образуется напрямую. Однако, пара водородных атомов (потому что реакция происходит дважды) - удаляется и подбирается НАД+ чтобы передать на электронную транспортную цепь с образованием диоксида углерода.
Ацетиловая порция ацетил-коэнзима-А соединяется с оксалоацетатом и образует цитрат (таже самая 6-углеродная лимонная кислота, обнаруживаемая в лимоне), которая затем проходит через цикл лимонной кислоты.
Ацетиловая порция ацетил-коэнзима-А соединяется с оксалоацетатом и образует цитрат (таже самая 6-углеродная лимонная кислота, обнаруживаемая в лимоне), которая затем проходит через цикл лимонной кислоты.
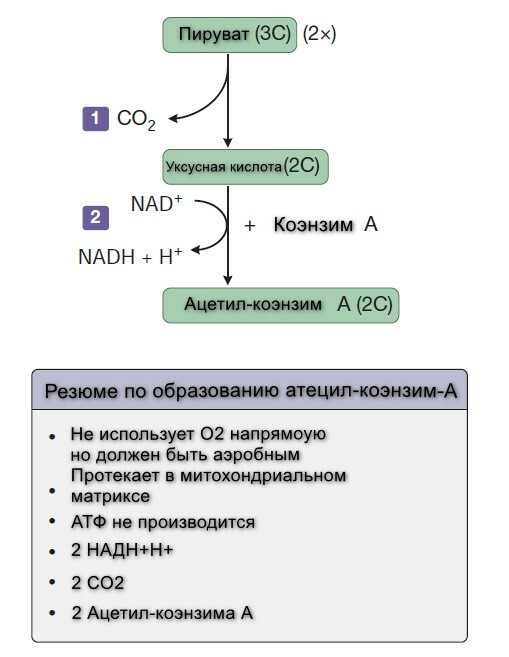
Конверсия пирувата в ацетил-коэнзим-А происходит внутри митохондриального матрикса. Это превращение требует, чтобы пируват был транспортирован через митохондриальные мембраны специальными переносчиками. Кислород напрямую не используется на этой стадии, но это шаги происходят только в присутствии кислорода. Как обычно, ферменты катализируют каждую реакцию.
Стадии Шага II
Согласно диаграмме выше, существует две стадии для Шага II.
Стадия 1. Пируват конвертируется в уксусную кислоту. В этом процесса одна молекула СО2 удаляется. Эта СО2, так же, как и СО2 в Шаге 3, диффундирует в кровоток и выдыхается легкими. Пируват декарбоксилируется в присутствии тиминдифосфата (компонент пируватдегидрогеназного комплекса) с образованием цетиллипоамида (содержащий липоевую кислоту) и уксусной кислоты.
Стадия 2. Уксусная кислота связывается с коэнзимом А и формирует ацетил-коэнзим-А. Коэнзим - непротеиновое вещество, получаемое из витамина, который активирует ферменты. В присутствии фермента дигидролипоилтрансферазы ацетиллипоамид реагирует с коферментом А, образуя ацетил-СоА и восстановленный липоамид.
Стадия 1. Пируват конвертируется в уксусную кислоту. В этом процесса одна молекула СО2 удаляется. Эта СО2, так же, как и СО2 в Шаге 3, диффундирует в кровоток и выдыхается легкими. Пируват декарбоксилируется в присутствии тиминдифосфата (компонент пируватдегидрогеназного комплекса) с образованием цетиллипоамида (содержащий липоевую кислоту) и уксусной кислоты.
Стадия 2. Уксусная кислота связывается с коэнзимом А и формирует ацетил-коэнзим-А. Коэнзим - непротеиновое вещество, получаемое из витамина, который активирует ферменты. В присутствии фермента дигидролипоилтрансферазы ацетиллипоамид реагирует с коферментом А, образуя ацетил-СоА и восстановленный липоамид.
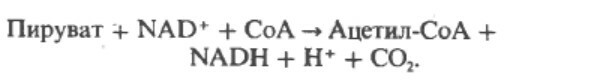
Пируватдегидрогенеза регулирется конечным продуктом и ковалентной модификацией
Пируват дегидрогеназа блокируется своими продуктами, ацетил-СоА и NADH. Она также регулируется фосфорилированием (катализируемым киназой) ее сериновых остатков на пируватдегидрогеназом компоненте мультферментативного комплекса, приводя к повышенной активности и дефосфорилированию (катализируемого фосфатазой), что повышает работу фермента.
Киназа активируется повышенными отношениями [ATP]/[ADP], [ацетил-СоА]/[CoA], и [NADH]/[NAD+].
Таким образом, пируватдегидрогеназа, а значит и гликолиз, блокируется как при адекватном количестве АТФ и при окислении жирных кислот. При голодании, когда содержание нэстерифицированных жирных кислот увеличивается, происходит снижение пропорции ферментов в активной форме, приводя к накоплению углеводов. В жировой ткане, глюкоза обеспечивает ацетил-СоА для липогенеза, ферменты активируются в ответ на инсулин.
Киназа активируется повышенными отношениями [ATP]/[ADP], [ацетил-СоА]/[CoA], и [NADH]/[NAD+].
Таким образом, пируватдегидрогеназа, а значит и гликолиз, блокируется как при адекватном количестве АТФ и при окислении жирных кислот. При голодании, когда содержание нэстерифицированных жирных кислот увеличивается, происходит снижение пропорции ферментов в активной форме, приводя к накоплению углеводов. В жировой ткане, глюкоза обеспечивает ацетил-СоА для липогенеза, ферменты активируются в ответ на инсулин.
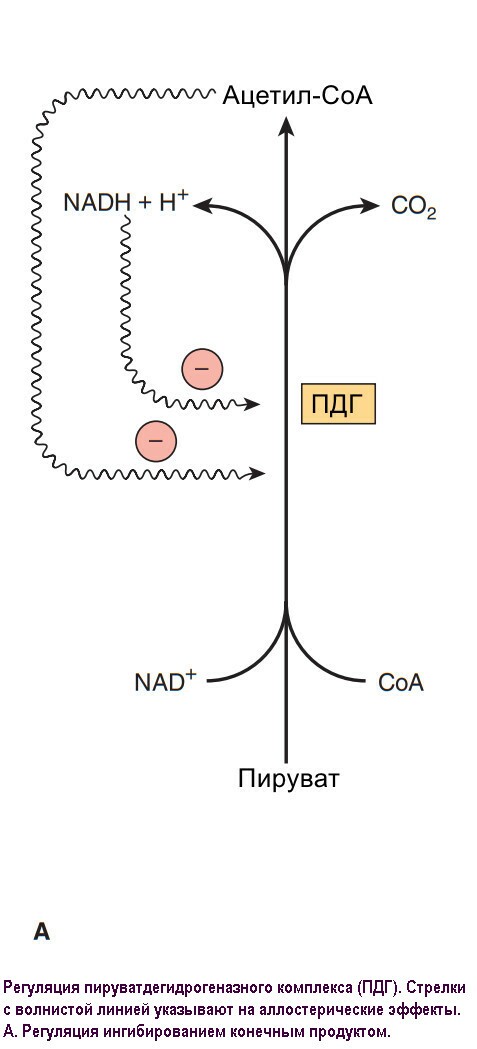
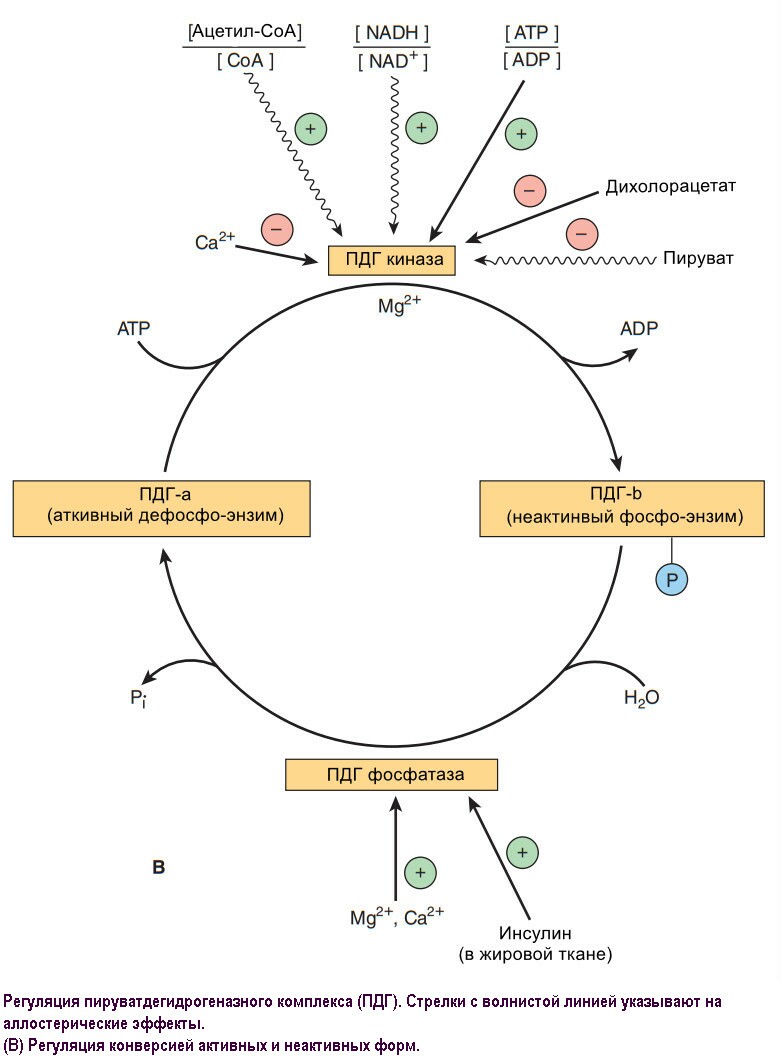
Клинические аспекты
Блокировка пируватного метаболизма приводит к лактазному ацидозу. Арсенит и также ионы ртути реагируют с -SH группами липоевой кислоты, входящей в состав пируватдегидрогеназного комплекса и блокурют ее; при недостаточности соедражния тиамина в диете активность пирватдегидрогеназы снижается и пируват может накапливаться. У многих алкоголиков дефицит тиамина (как из-за плохого питания, так и в результате того, что алкоголь блокирует всасываение тиамина) может развиаться потенциально фатальный пировиноградный и лактатный ацидоз. Пациенты, с наследственной недостаточностью пирватдегидрогеназы, также могут иметь лактатный ацидоз, особенно после нагрузки глюкозой. Так как мозг зависит от глюкозы, как топлива, метаболические дефекты часто вызывают неврологические нарушения.
Наследственный дефицит адолазы А и пируваткиназы в эритроцитах вызывает гемолитическую анемию.
Наследственный дефицит адолазы А и пируваткиназы в эритроцитах вызывает гемолитическую анемию.
Шаг III: цикл Кребса (подробнее см.выше)
Анаэробные реакции в гликолизе высвобождают около 5% энерегии из одиной молекулы глюкозы. Выделение остальной энерегии продолжается когда пирват необратимо конвертируется в ацетил-коэнзим-А, форма уксусной кислоты. Ацетил-коэнзим-А входит в цикл лимонной кислоты (цикл Кребса, или цикл трикарбоновых кислот). На рисунке ниже схематически показано, как лимонная кислота распадается на ацетил-коэнзима-А-субстрате до двуокиси углерода и атом водорода в пределах митохондрии. АТФ образует, когда атомы водорода окисляются во время электрон-транспортного окислительного фосфорилирования.
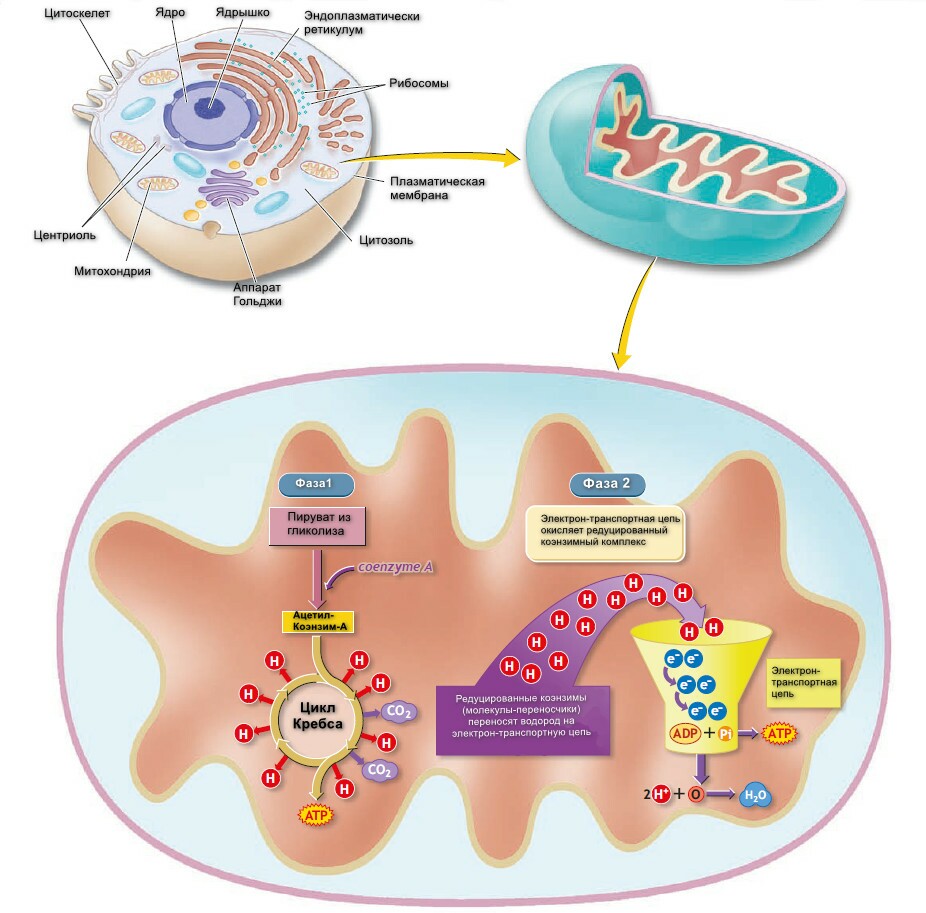
Рис4: Аэробный энергетический метаболизм. Фаза1. В митохондрии лимонная кислота образует атомы водорода во время распада ацетил-коэнзима-А. Фаза2. Существенное количество АФТ регенерируется когда эти атомы водорода окисляются в аэробном процессе электрон-транспортного окислительного фосфорилирования (электрон-транспортная цепь).
Цикл Кребса - является циклом, так как начинается и заканчивается на том же субстрате, называемом оксалоацетат (или щавалевоуксусная кислота, аббревиатура OAA, ЩУК). Этот цикл является 8-этапным процессом, который включает два метаболических путя: один - для этапов с 1 по 3, и второй - для этапов с 4 по 8.
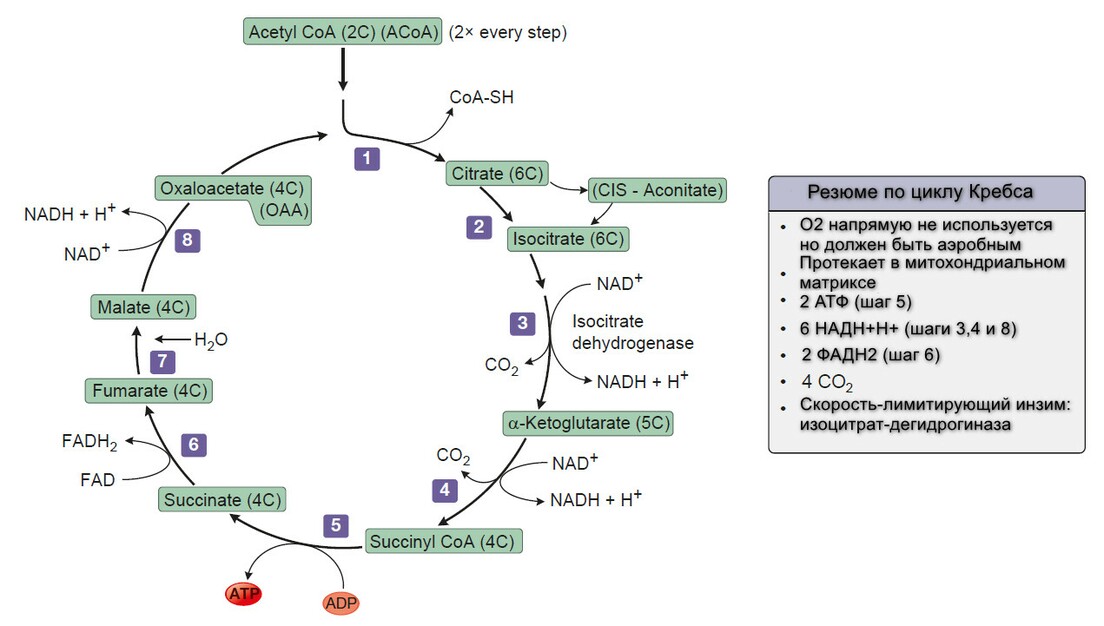
Никакой молеклы АТФ не используется в цикле Кребса, и только на одном этапе (5) в результате субстрат-уровневой фосфорилизации продуцируется АТФ. Однако, в 4 шагах (3, 4, 6 и 8) отделяются атомы водорода и подбираются НАД+ или ФАД. Это критически важно, потому что эти атомы водорода будут передавать электроны в электронную транспортную систему. Диоксид углерода, образуется на этапах 3 и 4. Здесь реакции также удваиваются с момента распада сахара на две 3-углеродные частицы.
Все ферменты, участвующие в цикле Кребца находятся в митохондриальном матриксе, за исключением одного - в шаге 6 - сукцинатдегидрогеназа - она располагается на внутренней митохондриальной мемране.
Все ферменты, участвующие в цикле Кребца находятся в митохондриальном матриксе, за исключением одного - в шаге 6 - сукцинатдегидрогеназа - она располагается на внутренней митохондриальной мемране.
Этапы Шага 3
Этап 1. 2-углеродный ацетил-коэнзим-А, соединяется с 4-углеродной молекулой оксалоацетата (ОАА, ОА) в цитрат или лимонную кислоту. Этот цикл также известен под названием цикл лимонной кислоты. В реакции коэнзим А (CoA-SH) удаляется от ацетилкоэнзима-А и превращает больше пирувата в ацитил-коэнзим-А или используется дальше в цикле.
Этап 2. Атомы лимонной кислоты (цитрата) или реорганизуется в изоцитрат. Иногда эта реорганизация включает промежуточный субстрат, цис-аконитат, продуцируемый между цитратом и изоцитратом (на схеме в скобка). Однако, этот шаг не обязательный, и единственный фермент, аконитаза, катализирует обе реакции.
Этап 3. Здесь происходит 2 реакции. Первая - атомы водорода удаляются и присоединяются к переносчику НАД+, образуя НАДН+Н+. Вторая - СО2 удаляется, оставляя 5-карбон-альфа-кетоглутарат.
Этап 4. В целом это повторение этапа 3. В дополнение, оставшаяся структура присоединяется к коэнзиму А (СоА-SH). Результирующий сукцинил-коэнзим-А имеет 4 атома углерода, которые остаются интактными до конца цикла.
Этап 5. На этом шаге коэнзим-А смещается фосфатной группой, которая в свою очередь переносится веществу, называемому гуанозин-дифосфат (ГДФ, GDP), c образованием гуанозин-трифосфата (GTP, ГТФ). ГТФ - это эквивалент АТФ, в плане энергии, и называется здесь АТФ. Это единственный этап в цикле Кребса, в котором производится и откладывается энерегия напрямую. Как и в гликолизе, эта АТФ производится в результате субстратного фосфорилирования.
Этап 6. Больше атомов водорода удаляется, но в то же время переносчик FAD, образует FADH2.
Этап 7. Добавляется овода, превращая фумарат в малат.
Этап 8. Пара водородов удаляется и принимается НАД+. Оставшиеся атомы образуют оксалоацетат, и цикл готов начаться снова.
АТФ, образуемые с шагах 1 и 3 могут использоваться немедленно, поставляя энергию клетке. СО2, образуемый в Шаге 2 диффундирует в кровоток и выводится легкими.
Этап 2. Атомы лимонной кислоты (цитрата) или реорганизуется в изоцитрат. Иногда эта реорганизация включает промежуточный субстрат, цис-аконитат, продуцируемый между цитратом и изоцитратом (на схеме в скобка). Однако, этот шаг не обязательный, и единственный фермент, аконитаза, катализирует обе реакции.
Этап 3. Здесь происходит 2 реакции. Первая - атомы водорода удаляются и присоединяются к переносчику НАД+, образуя НАДН+Н+. Вторая - СО2 удаляется, оставляя 5-карбон-альфа-кетоглутарат.
Этап 4. В целом это повторение этапа 3. В дополнение, оставшаяся структура присоединяется к коэнзиму А (СоА-SH). Результирующий сукцинил-коэнзим-А имеет 4 атома углерода, которые остаются интактными до конца цикла.
Этап 5. На этом шаге коэнзим-А смещается фосфатной группой, которая в свою очередь переносится веществу, называемому гуанозин-дифосфат (ГДФ, GDP), c образованием гуанозин-трифосфата (GTP, ГТФ). ГТФ - это эквивалент АТФ, в плане энергии, и называется здесь АТФ. Это единственный этап в цикле Кребса, в котором производится и откладывается энерегия напрямую. Как и в гликолизе, эта АТФ производится в результате субстратного фосфорилирования.
Этап 6. Больше атомов водорода удаляется, но в то же время переносчик FAD, образует FADH2.
Этап 7. Добавляется овода, превращая фумарат в малат.
Этап 8. Пара водородов удаляется и принимается НАД+. Оставшиеся атомы образуют оксалоацетат, и цикл готов начаться снова.
АТФ, образуемые с шагах 1 и 3 могут использоваться немедленно, поставляя энергию клетке. СО2, образуемый в Шаге 2 диффундирует в кровоток и выводится легкими.
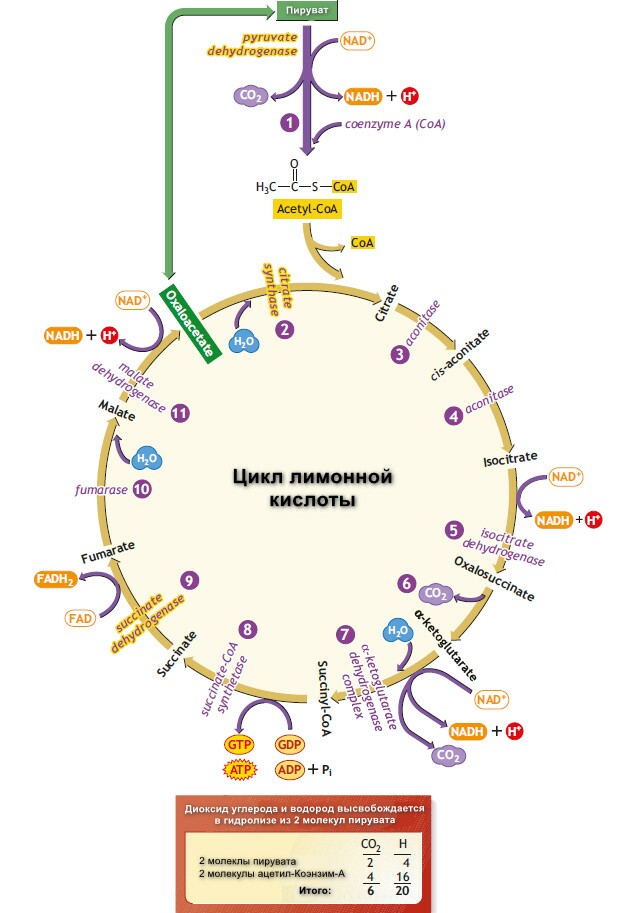
Подводя итог из схемы выше, образование двух молекул ацетил-коэнзима-А из двух молекул пирвата, образуемых в гликолизе, высвобождает 4 водорода, тогда, как в цикле лимонной кислоты высвобождается 16 водородов.
Основная функция цикла лимонной кислоты генерировать электроны (Н+) для передачи на дыхательную цепь с NAD+ и FAD. При адекватном количестве кислорода, включая ферменты и субстраты, NAD+ и FAD регенерируют, и метаболизм цикла Кребса продолжается безспрепятственно.
Цикл лимонной кислоты, электронный транспорт и окислительное фосфорилирование представляют три компонента аэробного метаболизма.
Основная функция цикла лимонной кислоты генерировать электроны (Н+) для передачи на дыхательную цепь с NAD+ и FAD. При адекватном количестве кислорода, включая ферменты и субстраты, NAD+ и FAD регенерируют, и метаболизм цикла Кребса продолжается безспрепятственно.
Цикл лимонной кислоты, электронный транспорт и окислительное фосфорилирование представляют три компонента аэробного метаболизма.
Шаг IV: электронный транспорт и окислительное фосфорилирование
Электронная транспортная система (ЭТС) или дыхательная цепь - это финальный матаболический путь в продукции АТФ. Она производит серии химических реакций в митохондрии, которые переносят электроны с атомов водорода переносчиков НАД и ФАД на кислород. Вода образуется, как побочный продукт, а электрохимическая энергия, высвобождаемая ионами водорода собирается в образованием АТФ из АДФ и Ф. Цепь сама по себе состоит из серии переносчиков электронов и протонных насосов, встроенных во внутреннюю мембрану митохондрии. Большинство переносчиков - белки или белки, соединенные ионами металлов (такими, как железо, Fe), которые присоединяют е-. Основные переносчики указаны на рисунке. Четыре этих переносчика стационарны: комплексы I, II, III и IV. Три (I, III и IV) - встроены во внутреннюю мемабрану митохондрий, тогда как комплекс II - прикреплен к внутренней мембране митохондрий со стороны матрикса. Цитохромы b и с1 - элементы Комплекса III, а цитохромы а и а3 - частью Комплекса IV. Коэнзим Q и цитохром с - подвижные и диффундируют через внутреннюю мембрану, неся электроны. Коэнзим Q двигается от Комплекса I и II к Комплексу III, а цитохром с двигается от Комплекса III к IV.
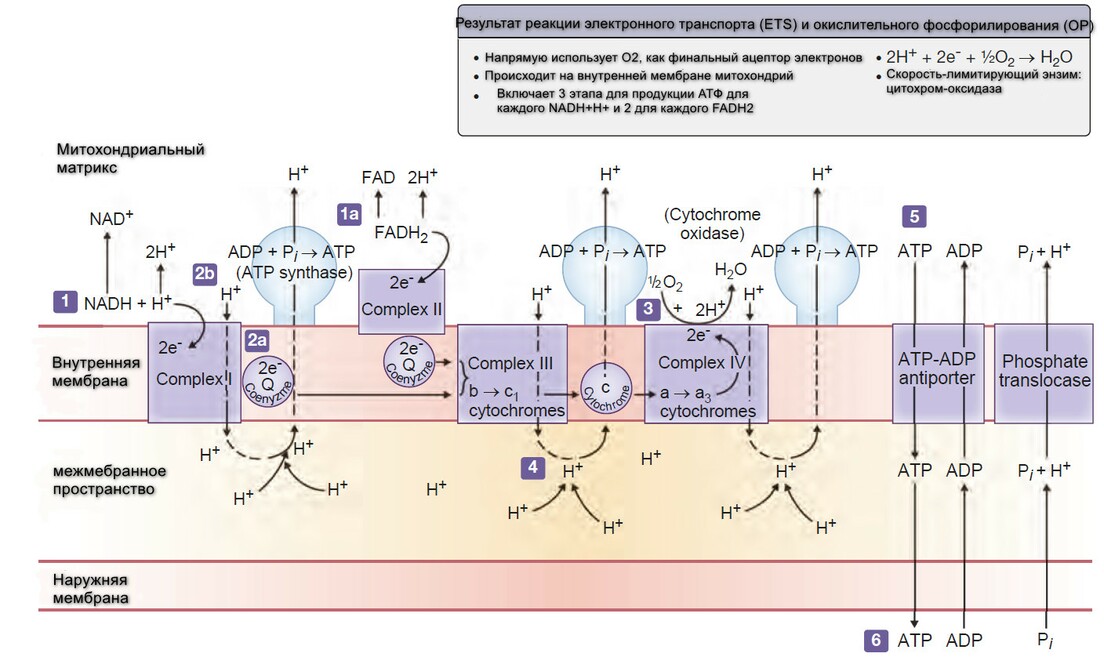
H+ и е- получаются в результате распада атомов водорода, высвобождаемых в Шагах I, II и III и транспортируются электрон-транспортной системой NAD+ и FAD:
2H=2Н+ + 2е-
H+ в начале откладывается в митохондриальный матрикс, а затем двигается через протонные помпы в межмебранное пространство. е- переносится от одного электронного акцептора к другому. е- движется по серии окислительно-восстановительных (редукционных) реакций, потому что каждый последующий переносчик в цепи имеет большую аффинность (силу химического притяжения) чем, предыдущий. Кислород имеет наибольшую аффинность для электронов и действует, как финальный акцептор е-. Дополнительные электроны на кислороде придаются отрицательный заряд и притягивают положительно заряженные H+, и таким образом образуется вода.
2H=2Н+ + 2е-
H+ в начале откладывается в митохондриальный матрикс, а затем двигается через протонные помпы в межмебранное пространство. е- переносится от одного электронного акцептора к другому. е- движется по серии окислительно-восстановительных (редукционных) реакций, потому что каждый последующий переносчик в цепи имеет большую аффинность (силу химического притяжения) чем, предыдущий. Кислород имеет наибольшую аффинность для электронов и действует, как финальный акцептор е-. Дополнительные электроны на кислороде придаются отрицательный заряд и притягивают положительно заряженные H+, и таким образом образуется вода.
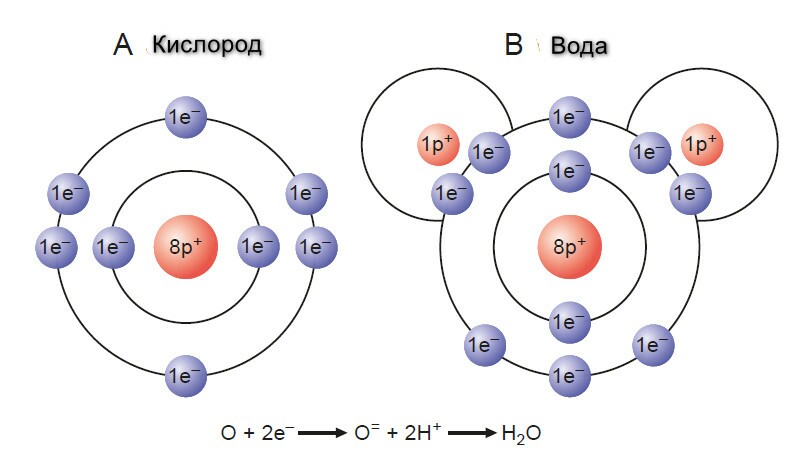
Рис.3 Кислород - как финальный акцептор электрона. А. Наружная оболочка кислорода для 8 электронов, но содержит только 6. Таким образом, она может принять еще 2 электрона, и это закончит электронный транспорт. В. Когда кислород присоединяет эти 2 электрона, он имеет дважды негативный заряд (О2-). Два атома водорода (Н+) притягиваются, и образуется вода.
Другие Н+ двигаются обратно из межмембранного пространства в матрикс через аппарат "мяч-и-стебель". Это движение Н+ активируется АФТ-синтетазу, которая фосфорилируется АДФ в АТФ.
Таким образом образование АТФ из АДФ и Pi контрориуется движением Н+ и е- через длинную электрон-транспортную цепь. Движение этих ионов высвобождает энергию, которая используется на то, что АДФ фосфорилируется до АТФ. Когда добавляется фосфат (фосфорилизация), а когда NADH+H+ и FADH2 окисляются (удаляются электроны), то используется термин окислительное фосфорилирование (ОФ), чтобы назвать образование АТФ.
Помните, процесс образования АФТ напрямую в гликолизе и цикле Кребса был назван субстратным фосфорилированием, потому что Рi переносится напрямую с фосфорилированных промежуточных субстратов на АДФ, без какого-либо окисления.
Во время окислительного фосфорилирования, синтезируется АТФ путем транспортировки электронов с NADH и FADH2 на кислород.
Таким образом образование АТФ из АДФ и Pi контрориуется движением Н+ и е- через длинную электрон-транспортную цепь. Движение этих ионов высвобождает энергию, которая используется на то, что АДФ фосфорилируется до АТФ. Когда добавляется фосфат (фосфорилизация), а когда NADH+H+ и FADH2 окисляются (удаляются электроны), то используется термин окислительное фосфорилирование (ОФ), чтобы назвать образование АТФ.
Помните, процесс образования АФТ напрямую в гликолизе и цикле Кребса был назван субстратным фосфорилированием, потому что Рi переносится напрямую с фосфорилированных промежуточных субстратов на АДФ, без какого-либо окисления.
Во время окислительного фосфорилирования, синтезируется АТФ путем транспортировки электронов с NADH и FADH2 на кислород.
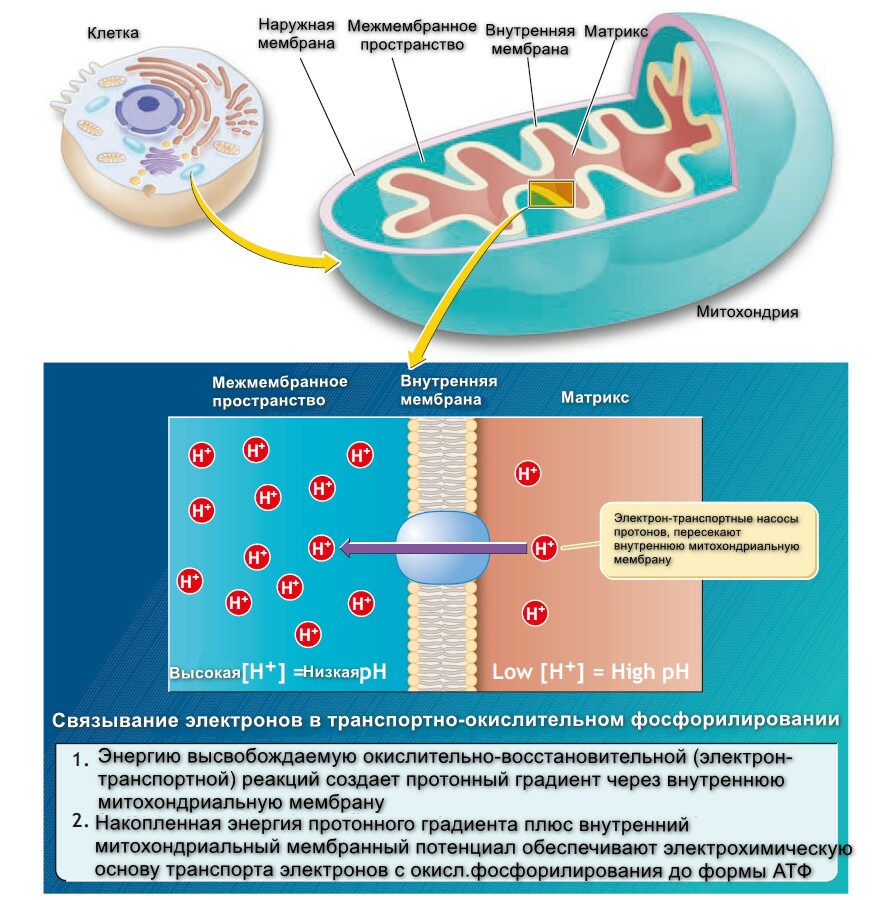
На рисунке выше иллюстрируется, что энерегия, генерируемя в реакциях электронного транспорта прокачивает протоны через внутренню митохондриальную мембрану в межмембранное пространство. Электрохимический градиент, образуемый во время этого обратного потока протонов отображает накопленную потенциальную энергию. Это обеспечивает механизм связывания АДФ и фосфатного иона в синтезированную АТФ. Внутренняя мембрана остается непроницаемой для АТФ, поэтому протеиновый комплекс АТФ/АДФ-транслоказа перепраляет только что синтезированные молекулы АТФ. В свою очередь АДФ и Рi переносятся в митохондрию, для последующего синтеза АТФ. Биохимики называют это образование хемиосмотическая связь. Более, чем 90% синтезируемого АТФ образуется в дыхательной цепи путем окислительных реакций с реакцией фосфорилирования.
Окисление водорода и последующее фосфорилирование происходит в следующем порядке:
NADH+H+ + 3ADP + 3Pi + 1/2O2 -->NAD+ + H2O + 3 ATP
Отношение фосфатных связей, формируемых для поглощения атомов кислорода (Р/О отношение) отражает количественно продукцию АТФ в электронном транспорте. В реакции описанной выше, Р/О равно 3 на каждый окисленный NADH плюс H+. Однако, если FADH2 является донором водородов, то образуется только 2 молекулы АТФ на каждый водород (Р/О отношение = 2). Это происходит потому, что FADH2 входит в дыхательную цепь на более низком энерегетическом уровне, чем тот, где синтезируется первая молекула АТФ (рис3 А)
Окисление водорода и последующее фосфорилирование происходит в следующем порядке:
NADH+H+ + 3ADP + 3Pi + 1/2O2 -->NAD+ + H2O + 3 ATP
Отношение фосфатных связей, формируемых для поглощения атомов кислорода (Р/О отношение) отражает количественно продукцию АТФ в электронном транспорте. В реакции описанной выше, Р/О равно 3 на каждый окисленный NADH плюс H+. Однако, если FADH2 является донором водородов, то образуется только 2 молекулы АТФ на каждый водород (Р/О отношение = 2). Это происходит потому, что FADH2 входит в дыхательную цепь на более низком энерегетическом уровне, чем тот, где синтезируется первая молекула АТФ (рис3 А)
Стадии Шага III
Стадия 1. NADH+H+ прибывает к Комплексу I, перенося электроны (е-) на комплекс, и депозирует протоны (Н+) в митохондриальном матриксе.
Стадия 1а. Это вариация. Если оригинальный переносчик водорода был FAD, вместо NAD+, перенос электронов и протонов происходит не в Комплексе II, а не в Комплексе I.
Стадия 2а. Электроны сбрасываются на цитохромы, альтернативно вызывая приобретение (становятся редуцированными) или потерю (становятся окисленными) электронов.
Стадия 2b. В этом процессе электроны также в толще внутренней мембраны, вызывая протонные насосы переносить H+ из матрикса в пространство внутренней мембраны.
Стадия 3. Кислород принимает электроны. Увеличенный отрицательный заряд притягивает ионы водородов, и вызывает образование воды.
Стадия 4. Н+, которые были транспортированы в межмебранное пространство создают электрохимический градиент. Когда движение выравнивает градиент, Н+ утекают обратно в метохондриальный матрикс через комплексы "мяч и стебель", которые являются ферментом АТФ-синтетаза. Движение Н+ создает электрический ток, и эта электрическая энергия, вместе с ферментативным действие, каким-то образом синтезирует АТФ из АДФ+Рi, которые присутствуют в матриксе. Это происходит 3 раза, если переносчик NАDН+Н+ и дважды, если переносчик FADH2.
Стадия 5. АТФ двигается в межмебранное пространство через АТФ-АДФ антипересной протеин. Для каждой экспортируемой АТФ молекулы импортируется молекула АДФ. Pi движется в митохондриальный матрикс через фосфат-транслоказный протеин вместе с H+.
Стадия 6. Финальный шаг, АТФ выходит из митохондрии в обмен на входящий АДФ, необходимую для постоянной продукции энергии.
Стадия 1а. Это вариация. Если оригинальный переносчик водорода был FAD, вместо NAD+, перенос электронов и протонов происходит не в Комплексе II, а не в Комплексе I.
Стадия 2а. Электроны сбрасываются на цитохромы, альтернативно вызывая приобретение (становятся редуцированными) или потерю (становятся окисленными) электронов.
Стадия 2b. В этом процессе электроны также в толще внутренней мембраны, вызывая протонные насосы переносить H+ из матрикса в пространство внутренней мембраны.
Стадия 3. Кислород принимает электроны. Увеличенный отрицательный заряд притягивает ионы водородов, и вызывает образование воды.
Стадия 4. Н+, которые были транспортированы в межмебранное пространство создают электрохимический градиент. Когда движение выравнивает градиент, Н+ утекают обратно в метохондриальный матрикс через комплексы "мяч и стебель", которые являются ферментом АТФ-синтетаза. Движение Н+ создает электрический ток, и эта электрическая энергия, вместе с ферментативным действие, каким-то образом синтезирует АТФ из АДФ+Рi, которые присутствуют в матриксе. Это происходит 3 раза, если переносчик NАDН+Н+ и дважды, если переносчик FADH2.
Стадия 5. АТФ двигается в межмебранное пространство через АТФ-АДФ антипересной протеин. Для каждой экспортируемой АТФ молекулы импортируется молекула АДФ. Pi движется в митохондриальный матрикс через фосфат-транслоказный протеин вместе с H+.
Стадия 6. Финальный шаг, АТФ выходит из митохондрии в обмен на входящий АДФ, необходимую для постоянной продукции энергии.
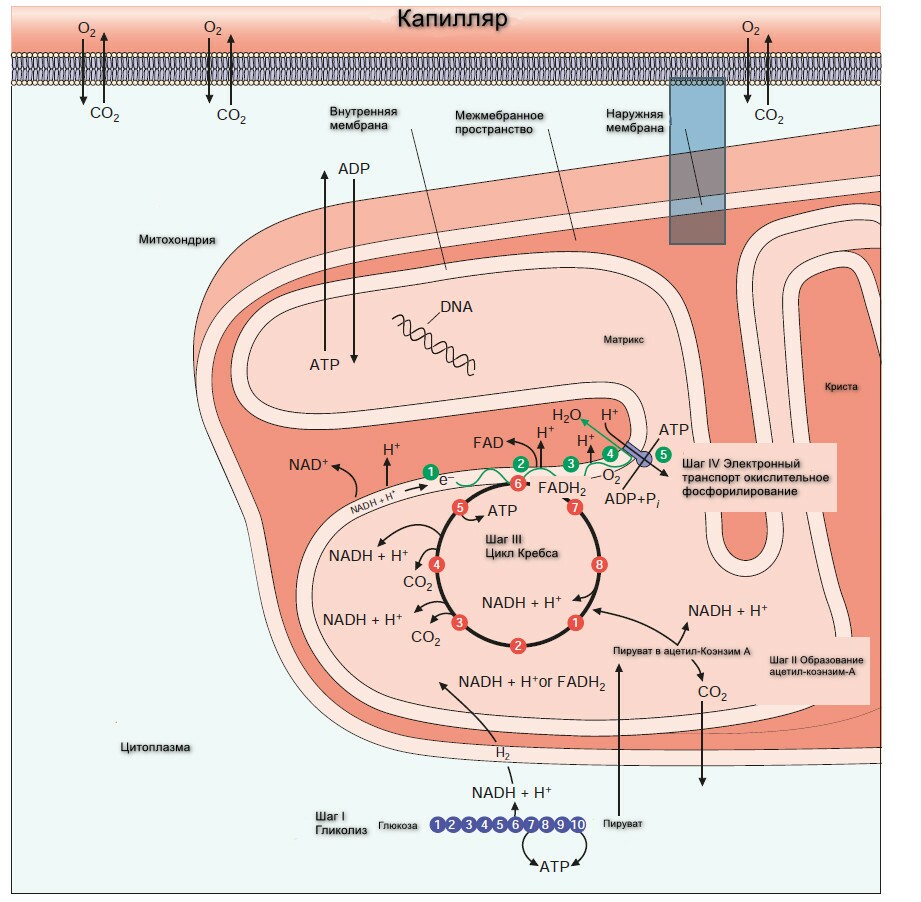
Рис.4 Клеточное дыхание
Рисунок 4 описывает процесс клеточного дыхания, только что разобранный выше, и отображает взаимоотношения в клетке.
Образование АТФ из углеводов
Количество АТФ, образуемого напряму из субстратного фосфорилирования и число водородных атомов, переносимых NAD+ и FAD были описаны выше. Эти данные резюмированы в таблице ниже.
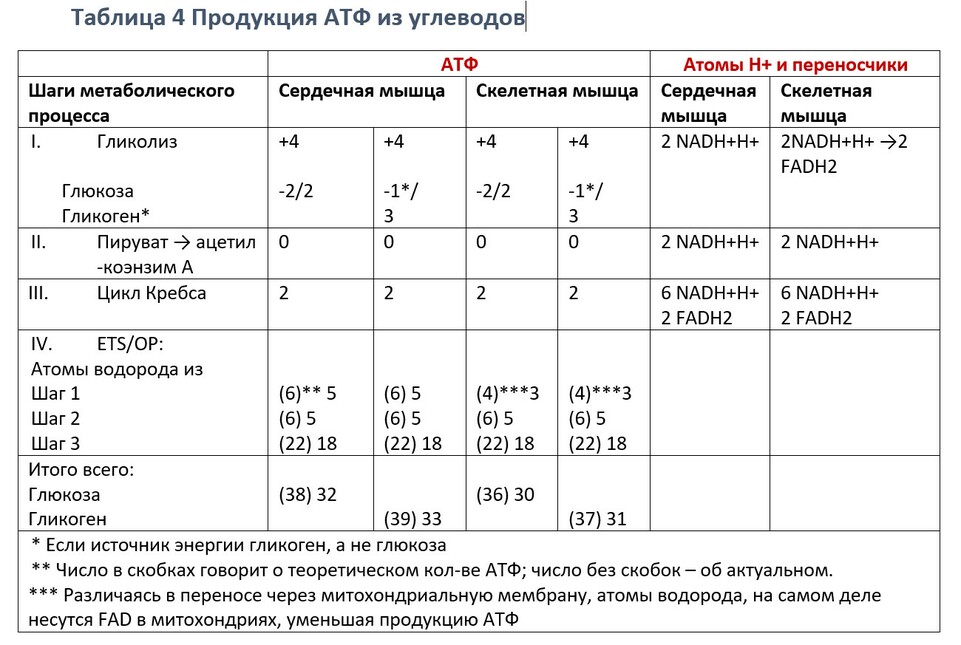
Шаг I (гликолиз) - в результате продуцируется 4 АТФ, но 2 АТФ тратится, в итоге 2 АТФ получается от прямого субстратного фосфорилирования, если субстрат глюкоза. Если субстрат гликоген, тратится только 1 АТФ, в итоге остается 3 АТФ.
На этом этапе производятся также две молекулы NADH+H+ . Эти атомы водорода из клеточной цитоплазмы транспортируются в митохондрии, если уровень пирувата не слишком высокий и достаточно кисорода, чтобы принять электроны и завершить электрон-транспортную передачу. Но для переноса NADH+H+ через митохондриальные мембраны необходимо воспользоваться системой переносчиков, так как они непроницаемы для NADH+H+. В сердечной мышце - это малат-аспартат-переносчик. В скелетной мышце - это глицерол-фосфатный переносчик. Эти переносчики забирают у NADH+H+ водород и переносят его через мембрану. В сердечной мышце митохондриальная NAD+ захватывает его, а в скелетной - FAD. Считается, что на участвует NADH+H+ то производится 3 молекулы АТФ, а если FADH2 - то 2 молекулы. Реальное число может быть меньше.
Шаг II (конверсия пирувата в ацетил-коэнзим-А), не является субстратным, но здесь производятся 2 NADH+H+. Так как эти молекулы уже в митохондрии, они вступают в ETS (электрон-транспортный перенос). Теоретически эти приводит к продукции 6 АТФ (2 NADH+H+ х 3), но на самом деле 5 АТФ (2 NADH+H+ x 2,5).
Шаг III (цикл Кребса) производит 2 АТФ непосредственно на субстратном фосфорилировании, NADH+H+ - в три шага, а FADH2 - в один шаг. Таким образом 3NADH+H+ х 3 = 9 АТФ теоретически, но на самом деле 3 NADH+H+ х 2,5 = 7,5 плюс 1 FADH2 x 2 = 2 AТФ теоретически, но на самом деле 1 FADH2 x 1,5 = 1,5 AТФ. Так как каждый шаг происходит дважды, то для каждой 6-углеродной молекулы глюкозы все уравнения удваиваются. 9 ATP + 2 ATP = 11 ATP × 2 = 22 ATP теоретически, но только 7.5 ATP + 1.5 ATP = 9 ATP × 2 = 18 ATP.
Каждый моль АТФ формируемый из АДФ сохраняет приблизительно 7 ккал энергии. Так как 2,5 моля АТФ образуется из 52 ккал энерегии, высвобождаемой при окислении 1 моля NADH, около 18 ккал накапливается в химической энергии. Это отражает относительную эффективность накопления химической энергии через электронный транспорт окислительного фосфорилирования в 34% (18 ккал / 52 ккал х 100%), оставшиеся 66% энерегии диссепирует в форме тепла.
На этом этапе производятся также две молекулы NADH+H+ . Эти атомы водорода из клеточной цитоплазмы транспортируются в митохондрии, если уровень пирувата не слишком высокий и достаточно кисорода, чтобы принять электроны и завершить электрон-транспортную передачу. Но для переноса NADH+H+ через митохондриальные мембраны необходимо воспользоваться системой переносчиков, так как они непроницаемы для NADH+H+. В сердечной мышце - это малат-аспартат-переносчик. В скелетной мышце - это глицерол-фосфатный переносчик. Эти переносчики забирают у NADH+H+ водород и переносят его через мембрану. В сердечной мышце митохондриальная NAD+ захватывает его, а в скелетной - FAD. Считается, что на участвует NADH+H+ то производится 3 молекулы АТФ, а если FADH2 - то 2 молекулы. Реальное число может быть меньше.
Шаг II (конверсия пирувата в ацетил-коэнзим-А), не является субстратным, но здесь производятся 2 NADH+H+. Так как эти молекулы уже в митохондрии, они вступают в ETS (электрон-транспортный перенос). Теоретически эти приводит к продукции 6 АТФ (2 NADH+H+ х 3), но на самом деле 5 АТФ (2 NADH+H+ x 2,5).
Шаг III (цикл Кребса) производит 2 АТФ непосредственно на субстратном фосфорилировании, NADH+H+ - в три шага, а FADH2 - в один шаг. Таким образом 3NADH+H+ х 3 = 9 АТФ теоретически, но на самом деле 3 NADH+H+ х 2,5 = 7,5 плюс 1 FADH2 x 2 = 2 AТФ теоретически, но на самом деле 1 FADH2 x 1,5 = 1,5 AТФ. Так как каждый шаг происходит дважды, то для каждой 6-углеродной молекулы глюкозы все уравнения удваиваются. 9 ATP + 2 ATP = 11 ATP × 2 = 22 ATP теоретически, но только 7.5 ATP + 1.5 ATP = 9 ATP × 2 = 18 ATP.
Каждый моль АТФ формируемый из АДФ сохраняет приблизительно 7 ккал энергии. Так как 2,5 моля АТФ образуется из 52 ккал энерегии, высвобождаемой при окислении 1 моля NADH, около 18 ккал накапливается в химической энергии. Это отражает относительную эффективность накопления химической энергии через электронный транспорт окислительного фосфорилирования в 34% (18 ккал / 52 ккал х 100%), оставшиеся 66% энерегии диссепирует в форме тепла.
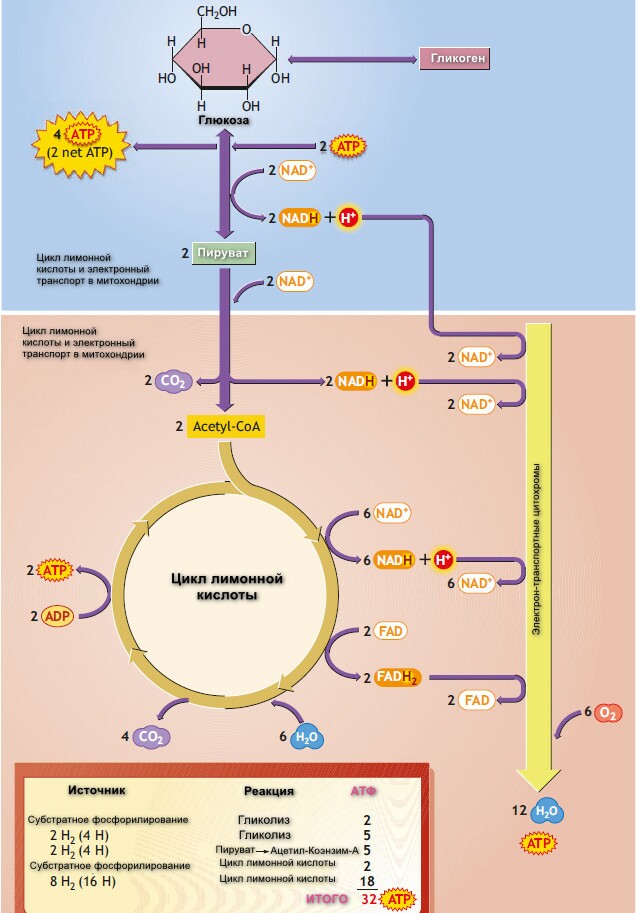
Рисунок подводит итого путей энергетической конверсии во время катаболизма гликозы в скелетной мышце. 2 молекулы АТФ из субстрат-уровневого фосфорилирования в гликолизе; также 2 молекулы АТФ появляются из деградации ацетил-Коэнзим-А в цикле Кребса. 24 высвобождаемых атома водорода могут быть посчитаны далее:
1. 4 эстрамитохондриальных водорода (2NADH) образуются в гликолизе, выделяя 5 АТФ во время окислительного фосфорилирования
2. 4 атома (2NADH) высвобождаются в митохондрии когда пируват деградирует до ацетил-коэнзим-А, образуются 5 АТФ
3. 2 гуанозин-трифосфата (ГТФ, молекула, аналогичная АТФ) продуцируются в цикле Кребса из субстрат-уровневого-фосфорилирования
4. 12 из 16 атомов водрода (6 NADH) высвобождаются в цикле Кребса и продуцируются 15 АТФ (6 NADHx2,5 АТФ на NADH = 15 АТФ).
5. 4 атома водорода присоединяются к FAD (2FADH2) в цикле лимонной кислоты и продуцируются 3 АТФ.
Полный распад глюкозы производит 34 молекулы АТФ. Так как 2 АТФ изначально фосфорилируют глюкозу, 32 АТФ - это остаток молекул образующихся в результате катаболизма глюкозы в скелетных мышцах. 4 АТФ образуются при субстратном фосфорилировании (гликолиз и цикл лимонной кислоты), когда 28 АТФ генеруруется во время окислительного фосфорилирования.
1. 4 эстрамитохондриальных водорода (2NADH) образуются в гликолизе, выделяя 5 АТФ во время окислительного фосфорилирования
2. 4 атома (2NADH) высвобождаются в митохондрии когда пируват деградирует до ацетил-коэнзим-А, образуются 5 АТФ
3. 2 гуанозин-трифосфата (ГТФ, молекула, аналогичная АТФ) продуцируются в цикле Кребса из субстрат-уровневого-фосфорилирования
4. 12 из 16 атомов водрода (6 NADH) высвобождаются в цикле Кребса и продуцируются 15 АТФ (6 NADHx2,5 АТФ на NADH = 15 АТФ).
5. 4 атома водорода присоединяются к FAD (2FADH2) в цикле лимонной кислоты и продуцируются 3 АТФ.
Полный распад глюкозы производит 34 молекулы АТФ. Так как 2 АТФ изначально фосфорилируют глюкозу, 32 АТФ - это остаток молекул образующихся в результате катаболизма глюкозы в скелетных мышцах. 4 АТФ образуются при субстратном фосфорилировании (гликолиз и цикл лимонной кислоты), когда 28 АТФ генеруруется во время окислительного фосфорилирования.
Таким образом, метаболизм глюкозы может происходит по различным направлениям, использующим ее энергетический потенацил. В базальном (доабсорбционном) состоянии печень вырабатывает глюкозу со скоростью, равной ее утилизации во всем организме. Примерно 30% производства глюкозы печень происходит за счет глюкогенолиза, а 70% - как результат глюконеогенеза. Общее содержание гликогена (500 г) при отсутствии поступления глюкозы, истощается через 12-18 часов. При отсутствии резервного гликогена в результате голодания резко усиливаются процессы окисления другого энергетического субстрата — жирных кислот. Одновременно увеличивается скорость глюконеогенеза, направленного в первую очередь на обеспечение глюкозой головного мозга, для которого она является основным источником энергии.
Синтез глюкозы происходит из аминокислот, лактата, пирувата, глицерина и жирных кислот с нечетной углеродной цепью. Большинство аминокислот способны быть предшественниками глюкозы, однако основную роль при этом, как сказано выше, играет аланин. Из аминокислотных источников происходит синтез примерно 6% эндогенной глюкозы, из глицерина, пирувата и лактата соответственно 2%, 1% и 16%. Вклад жирных кислот в глюконеогенез малозначим, поскольку лишь небольшой процент их имеет нечетное углеродное число.
При повышении концентрации глюкозы скорость ее утилизации периферическими тканями почти не изменяется, поэтому основным механизмом элиминации ее из кровотока является депонирование. Только небольшая часть избыточной глюкозы непосредственно участвует в липогенезе, который происходит в печени и в жировой ткани.
Синтез глюкозы происходит из аминокислот, лактата, пирувата, глицерина и жирных кислот с нечетной углеродной цепью. Большинство аминокислот способны быть предшественниками глюкозы, однако основную роль при этом, как сказано выше, играет аланин. Из аминокислотных источников происходит синтез примерно 6% эндогенной глюкозы, из глицерина, пирувата и лактата соответственно 2%, 1% и 16%. Вклад жирных кислот в глюконеогенез малозначим, поскольку лишь небольшой процент их имеет нечетное углеродное число.
При повышении концентрации глюкозы скорость ее утилизации периферическими тканями почти не изменяется, поэтому основным механизмом элиминации ее из кровотока является депонирование. Только небольшая часть избыточной глюкозы непосредственно участвует в липогенезе, который происходит в печени и в жировой ткани.
Метаболизм гликогена
Биомедицинское значение
Гликоген - главная форма запасания углеводов у животных; у растений эту роль играет крахмал. Как и крахмал, гликоген является разветвленным полимером альфа-глюкозы. Он накапливается главным образом в печени и мышцых. Приблизительно 3/4 общего гликогена организма находится в мышцах.
Мышечный гликоген обеспечивает готовый источник глюкозо-1фосфата для гликолиза в самой мышце. Мышечный гликоген функционирует в основном, как резерв, поддерживающий концентрацию сахара в крови в промежутках между приемами пищи. Печеночная концентрация гликогена олоко 450 ммоль/л эквивалента глюкозы после еды, и падает до 200 ммоль/л после ночного голодания. После 12-18 часов голодания, печеночный гликоген почти полностью истощается. Хотя мышечный гликоген не является прямым источником свободной глюкозы (из-за отсутствия в мышцах глюкозо-6-фосфатазы), пируват образуемый гликолизом в мышцах, может подвергаться трансаминированию до аланина, который экспортруется из мышц и используется для глюконеогенеза в печени. Болезни накопления гликогена - группа генетических заболеваний, при которых наблюдается нарушение метаболизма гликогена или отложение его в нефизиологических формах, приводя к поражению печени и мышечной слабости; некоторые болезни накопления гликогена приводят к смерти.
Высокоразветвленная структура гликогена обеспечивает большое чисто мест для гликогенолиза, обеспечивая быстрое высвобождение глюкозы-1-фосфата для мышечной работы. Атлетам высокоинтенсивных нагрузок требуется медленное, более постоянное высвобождение глюкозо-1-фосфата. Образование ветвей в гликогене медленнее, чем добавление единиц глюкозы в линейную цепь, и такие спортсмены практикуют углеводную загрузку - упражнения до изнемождения (до полного истощения мышечного гликогена), с последующей высокоуглеводным приемом пищи, в результате которого быстро строится гликоген, с меньшим количеством точек ветвления, чем обычно.
Мышечный гликоген обеспечивает готовый источник глюкозо-1фосфата для гликолиза в самой мышце. Мышечный гликоген функционирует в основном, как резерв, поддерживающий концентрацию сахара в крови в промежутках между приемами пищи. Печеночная концентрация гликогена олоко 450 ммоль/л эквивалента глюкозы после еды, и падает до 200 ммоль/л после ночного голодания. После 12-18 часов голодания, печеночный гликоген почти полностью истощается. Хотя мышечный гликоген не является прямым источником свободной глюкозы (из-за отсутствия в мышцах глюкозо-6-фосфатазы), пируват образуемый гликолизом в мышцах, может подвергаться трансаминированию до аланина, который экспортруется из мышц и используется для глюконеогенеза в печени. Болезни накопления гликогена - группа генетических заболеваний, при которых наблюдается нарушение метаболизма гликогена или отложение его в нефизиологических формах, приводя к поражению печени и мышечной слабости; некоторые болезни накопления гликогена приводят к смерти.
Высокоразветвленная структура гликогена обеспечивает большое чисто мест для гликогенолиза, обеспечивая быстрое высвобождение глюкозы-1-фосфата для мышечной работы. Атлетам высокоинтенсивных нагрузок требуется медленное, более постоянное высвобождение глюкозо-1-фосфата. Образование ветвей в гликогене медленнее, чем добавление единиц глюкозы в линейную цепь, и такие спортсмены практикуют углеводную загрузку - упражнения до изнемождения (до полного истощения мышечного гликогена), с последующей высокоуглеводным приемом пищи, в результате которого быстро строится гликоген, с меньшим количеством точек ветвления, чем обычно.
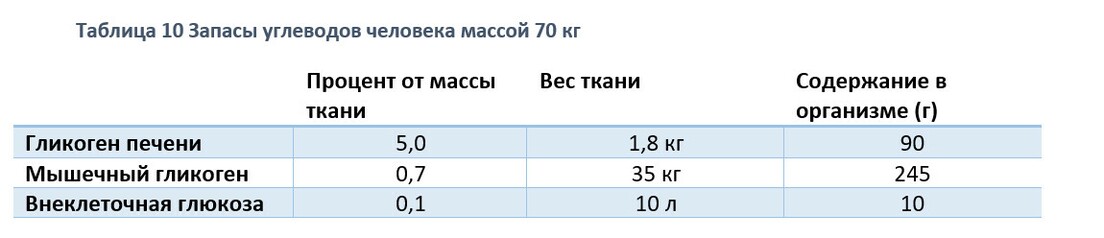
Гликогенез идет в основном в мышцых и печени
Биосинтез гликогена идет с участием уридиндифосфоглюкозы (УДФ-глюкоза)
Рисунок ниже демонстрирует ниже биосинтез гликогена, в который вовлечены отдельные единицы глюкозы к существующему полимеру гликогену.
Ступень 1. Глюкоза фосфорилируется до глюкозо-6-фосфата, это та реакция катализируется в мышцах гексокиназой, а в печени - глюкокиназой.
Ступень 2. Глюекозо-6-фосфат превращается в глюкозо-1-фосфат, в результате реакции, катализируемой фосфоглюкомутазой. Этот фермент (Ф) находится в фосфорилированной форме, его фосфогруппа (Р) участвует в обратимой реакции, промежуточным медиатором которой является глюкозо-1,6-бифосфат:
Ступень 1. Глюкоза фосфорилируется до глюкозо-6-фосфата, это та реакция катализируется в мышцах гексокиназой, а в печени - глюкокиназой.
Ступень 2. Глюекозо-6-фосфат превращается в глюкозо-1-фосфат, в результате реакции, катализируемой фосфоглюкомутазой. Этот фермент (Ф) находится в фосфорилированной форме, его фосфогруппа (Р) участвует в обратимой реакции, промежуточным медиатором которой является глюкозо-1,6-бифосфат:
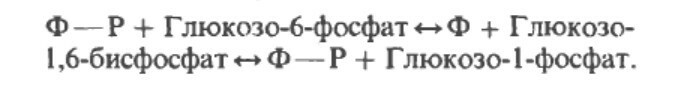
Ступень 3. Далее глюкозо-1-фосфат реагирует с урудинтрифофосфатом (UTP); в результате образуется активный неклеотид уридиндифосфатглюкоза (UDP-глюкоза).
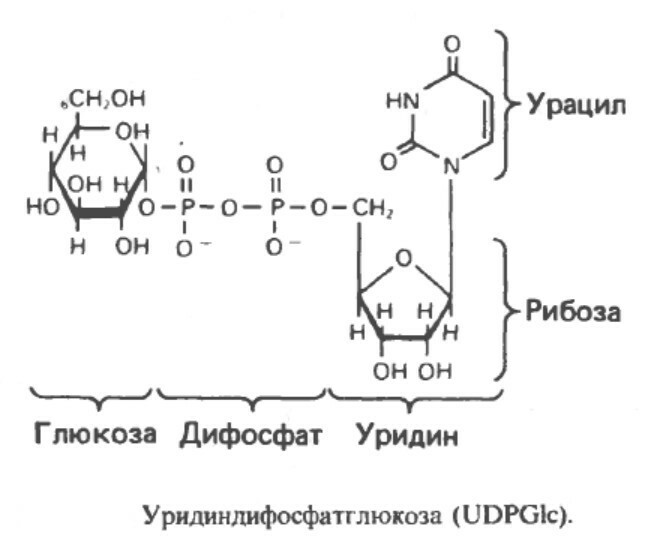
Реакция между глюкозо-1-фосфатом и уридинтрифосфатом катализируется ферментом UDP-глюкозапирофосфорилазой:
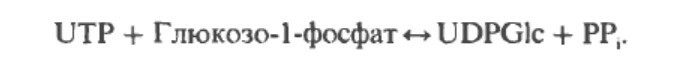
Ступень 4. Последующий гидролиз неорганического пирофосфата, катализируемый неорганической пирофосфатазой, сдвигает равновесие реакции вправо.
При действии фермента гликогенсинтетазы (или глюкозилтрансферазы) образуется гликозидная связь между атомом С1 активированной глюкозы, находящейся в составе UDPGlc, и атомом С4 концевого остатка глюкозы в гликогене с освобождением уридиндифосфата (UDP). Для инициирования этой реакции требуется молекула гликогена в качестве "затравки". Эта затравка может синтезироваться на остове пептидной цепи подобно тому, как это происходит при синтезе других гликопротеинов.
При действии фермента гликогенсинтетазы (или глюкозилтрансферазы) образуется гликозидная связь между атомом С1 активированной глюкозы, находящейся в составе UDPGlc, и атомом С4 концевого остатка глюкозы в гликогене с освобождением уридиндифосфата (UDP). Для инициирования этой реакции требуется молекула гликогена в качестве "затравки". Эта затравка может синтезироваться на остове пептидной цепи подобно тому, как это происходит при синтезе других гликопротеинов.
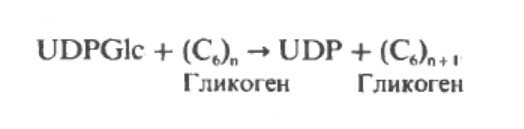
Ступень 4 демонстрирует увеличенный вид химической конфигурации молекулы гликогена. Синтез гликогена требует энергии, на ступени 1 - 1 аденозин-три-фосфат (АТФ) и 1 уридин-три-фосфоат (УТФ) (ступень 3), распадающие во время глюкогенеза.
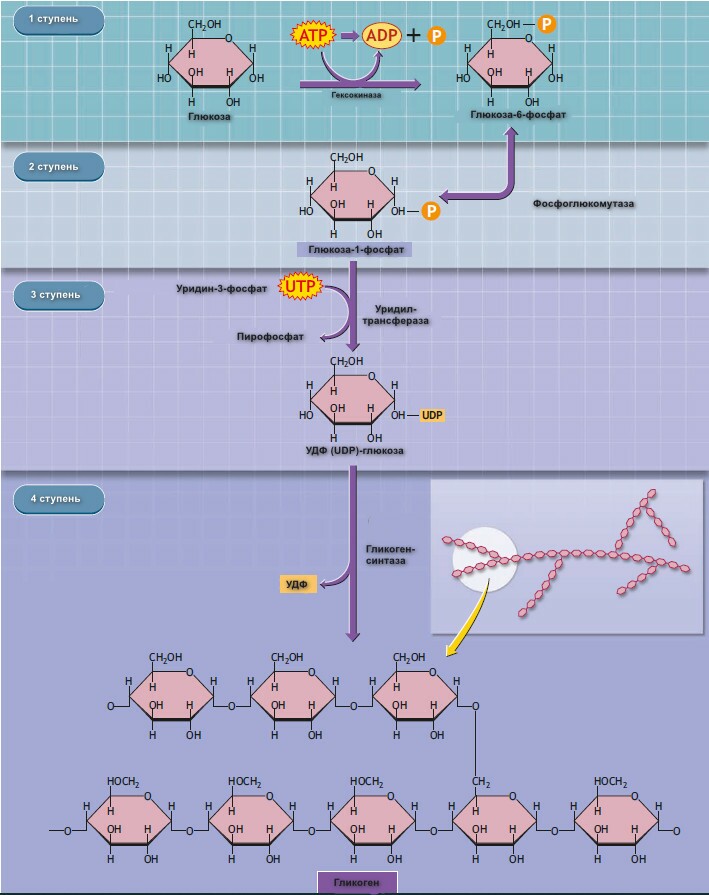
Механизм ветвления
Когда растущая цепь достигает, как минимум 11 глюкозных остатков, ветвящий фермент переносит часть с 1-4-цепи (с минимальной длиной в 6 остатков глюкозы) на соседнюю цепь, присоединяя к ней переносимый фрагмент (1-6)-связью; таким образом образуется точка ветвления в молекуле. Ветви растут путем последовательного присоединения (1-4)-глюкозильных единиц и дальнейшего ветвления.
Действие ветвящего фермента изучалось на животных путем добавления в пищу С14-меченой глюкозы с последующим исследованием гликогена печени через определенные интервалы времени.
Действие ветвящего фермента изучалось на животных путем добавления в пищу С14-меченой глюкозы с последующим исследованием гликогена печени через определенные интервалы времени.
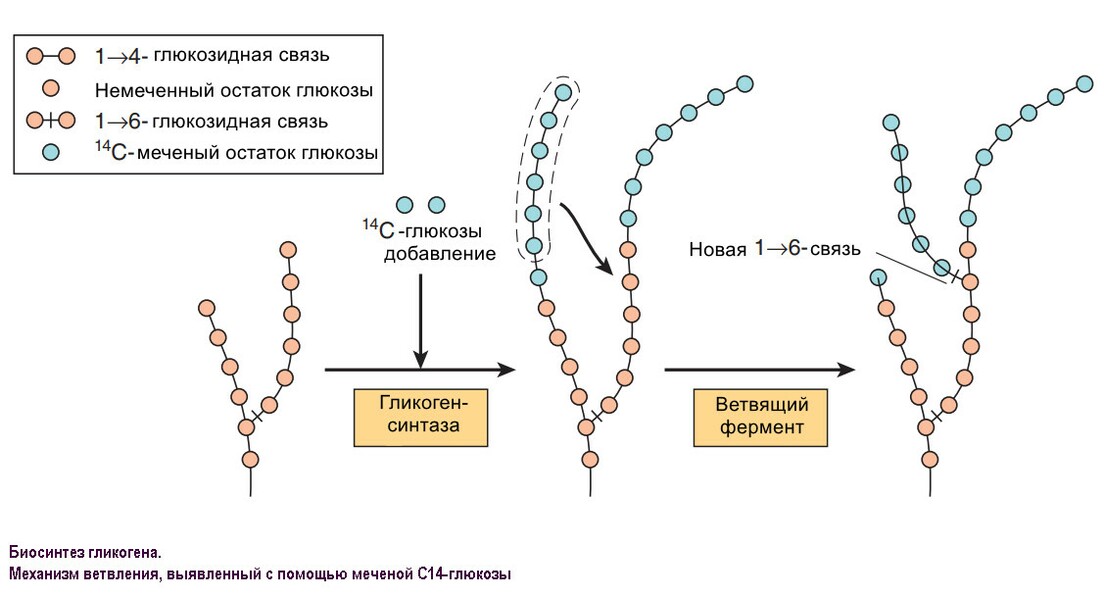
Гликогенолиз - это не обратный процесс гликогенеза, а отдельный путь
Стадией, лимитирующей скорость гликогенолиза, является реакция, катализируемая фосфорилазой:
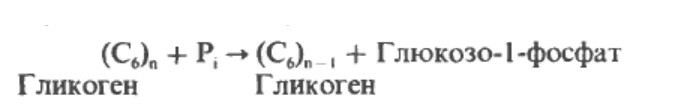
Фермент, специфично катализирует фосфорилитическое расщепление (фосфоролиз) (1-4)-связей гликогена, продуктом является глюкозо-1-фосфат.
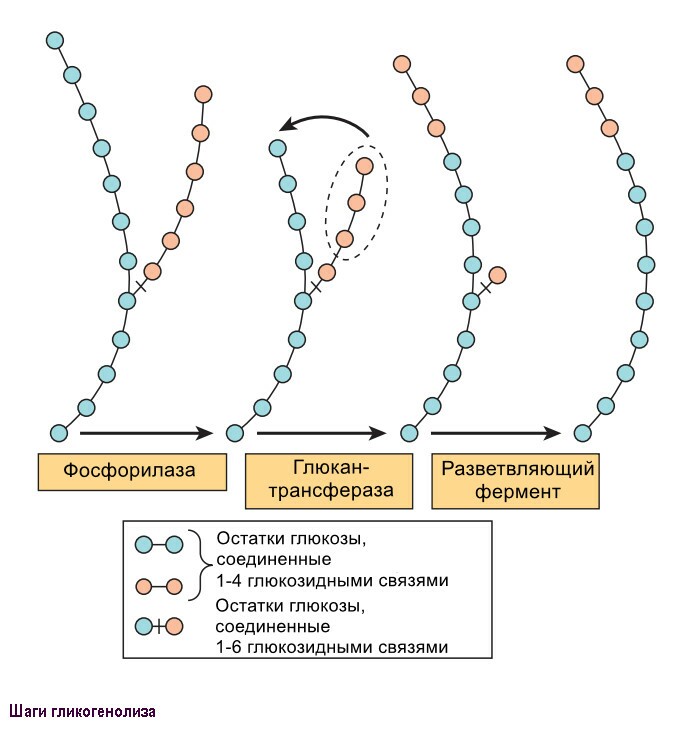
Глюкантрансфераза переносит трисахардиный фрагмент с одной цепи на другую, экспонируя (1-6)-пункт ветвления.
Гидролическое расщепление (1-6) связей осуществляет деветвящий (дебранчинг) фермент.
В печени и почках имеется специфический фермент глюкозо-6-фосфатаза, отщепляющий фосфат от глюкозо-6-фосфата. Образовавшаяся глюкоза диффиндирует из клеток в кровь. Это заключительная стадия гликогенолиза в печени, приводящая к повышению содержания глюкозы в крови.
Гранулы гликогена могут быть также поглощены лизосомами, где кислота мальтаза катализирует гидролиз гликогена до глюкозы. Это может быть важно в гомеостазе глюкозы у новорожденных. Генетечисеский дефект недостаточности лизосомальной кислоты мальтазы вызывает II тип болезни накопления гликогена. Лизосомальный катаболизм гликогена находится под гормональным контролем.
Гидролическое расщепление (1-6) связей осуществляет деветвящий (дебранчинг) фермент.
В печени и почках имеется специфический фермент глюкозо-6-фосфатаза, отщепляющий фосфат от глюкозо-6-фосфата. Образовавшаяся глюкоза диффиндирует из клеток в кровь. Это заключительная стадия гликогенолиза в печени, приводящая к повышению содержания глюкозы в крови.
Гранулы гликогена могут быть также поглощены лизосомами, где кислота мальтаза катализирует гидролиз гликогена до глюкозы. Это может быть важно в гомеостазе глюкозы у новорожденных. Генетечисеский дефект недостаточности лизосомальной кислоты мальтазы вызывает II тип болезни накопления гликогена. Лизосомальный катаболизм гликогена находится под гормональным контролем.
Механизмы контроля гликогенолиза и гликогенеза.
В цитоплазме печени и мышечных клетках содержатся гранулы гликогена и ферменты для синтеза гликогена (гликогенезис) и распада гликогена (гликогенолиз). При избытке глюкоза также вступает в энергетический метаболизм и откладывается в форме гликогена или конвертируется в жир. При высокой клеточной активности, доступная глюкоза окисляется через гликолитический путь, цикл лимонной кислоты и респираторную цепь с образованием АТФ. В противоположность, низкий уровень клеточной активности и/или недостатке гликогена, инактивируются ключевые гликолитические ферменты. Это заставляет излишек глюкозы преобразовывать в гликоген.
В печени фермент гликоген-фосфорилаза инактивируется после приема пищи, и активность гликоген-синтетазы и образование гликогена из глюкозы, поступаемой из пищи, увеличивается, чтобы наполнить хранилища, и поддержать стабильность плазматической глюкозы. Мышцы в покое демонстрируют большую синтетазную активностью, тогда как их работа увеличивать фосфорилазную активность с одновременным подавлением синтетазного фермента. Эпинефрин (адреналин), гормон симпатической нервной системы, ускоряет фосфорилирование глюкозы.
Действие адреналина описывается, как гликогенолитический каскад, так как этот гормон воздействует на фосфорилазную активацию, чтобы увеличить мобилизацию гликогена. Фосфорилазная активная является наиболее активной во время интенсивных упражнений, когда деятельность симпатической нервной системы увеличивается и углеводы доставляют достаточное количество энергии.
В печени фермент гликоген-фосфорилаза инактивируется после приема пищи, и активность гликоген-синтетазы и образование гликогена из глюкозы, поступаемой из пищи, увеличивается, чтобы наполнить хранилища, и поддержать стабильность плазматической глюкозы. Мышцы в покое демонстрируют большую синтетазную активностью, тогда как их работа увеличивать фосфорилазную активность с одновременным подавлением синтетазного фермента. Эпинефрин (адреналин), гормон симпатической нервной системы, ускоряет фосфорилирование глюкозы.
Действие адреналина описывается, как гликогенолитический каскад, так как этот гормон воздействует на фосфорилазную активацию, чтобы увеличить мобилизацию гликогена. Фосфорилазная активная является наиболее активной во время интенсивных упражнений, когда деятельность симпатической нервной системы увеличивается и углеводы доставляют достаточное количество энергии.
цАМФ участвует в регуляции гликокенолиза и гликогенеза
Главные ферменты, котролирующие метаболизм гликогена - гликогенфосфорилаза и гликогенсинтетаза - регулируются аллостерическими механизмами обратимого фосфорилирования и дефосфорилирования белка фермента в ответ на действие гормона. Фосфорилирование гликогенфосфорилазы увеличивает ее активность, фосфорилирование гликогенсинтетазы снижает ее активность.
Фосфорилирование увеличивается в ответ на цАМФ, образуемой из АТФ под действием аденилатцилаклазы, расположенной на внетренней поверхности клеточных мембран в ответ на такие гормоны, как адреналин, норадреналин и глюкагон. цАМФ гидролизируется фосфодиэстеразой, которая таким образом прекращает действие гормонов.
Фосфорилирование увеличивается в ответ на цАМФ, образуемой из АТФ под действием аденилатцилаклазы, расположенной на внетренней поверхности клеточных мембран в ответ на такие гормоны, как адреналин, норадреналин и глюкагон. цАМФ гидролизируется фосфодиэстеразой, которая таким образом прекращает действие гормонов.
Гликогенфосфорилаза регулируется по-разному в печени и мышцах
В печени роль гликогена - доставлять свободную глюкозу для экспорта и поддержания ее концентрации в крови; в мышцах роль гликогена - обеспечивать источник глюкозы-6-фосфата для гликолиза в ответ на потребности в необходимости АТФ для мышечных сокращений. В обоих тканях, фермент активируется фосфорилированием, катализируемым фосфорилкиназой и инактивируется дефосфорилированием, катализируемым фосфопротеинфосфатазой, в ответ на гормоны и другие сигналы.
цАМФ активирует гликогенфосфорилазу
Фосфорилкиназа активируется в ответ на цАМФ. Увеличение концентрации цАМФ активирует цАМФ-зависисимую протеинкиназу, которая каталиризирует фосфорилирование с участием АТФ неактивную фосфорилкиназу b, переходящую в активную фосфорилкиназу а. В печени цАМФ образуется в ответ на глюкагон, секретируемый в ответ на снижение уровня глюкозы в крови. Мышцы не чувствительны к глюкагону, и здесь сигналом для повышения образования цАМФ служит норадреналин, секретируемый в ответ на страх или испуг, когда необходимо увеличить гликогенолиз чтобы обеспечить быструю мышечную активность.
Са2+ синхронизирует активацию гликогенфосфорилазы с мышечными сокращениями
Гликогенолиз в мышцах увеличивается в несколько сотен раз при начле сокращений; тот же сигнал (повышение концентрации в цитозоле ионов Са2+) ответственен за начало как сокращений, так и гликогенолиз. Мышечная фосфорилкиназа, которая активирует гликогенфосфорилазу, содержит кальмодулин, белок, связывающий кальций. Фосфорилированная фосфорилкиназа а полностью активируется только при высоких концентрациях кальция.
Гликогенолиз в печени может быть цАМФ-независимым
В печени существует цАМФ-независимая активация гликогенолиза в ответ на стимуляцию альфа1-адренергических рецепторов адреналином и норадреналином. Это включает мобилизаую Са2+ в цитозоль, в ответ на стимуляцию кальций/кальмолудин-чувствительную фосфорилкиназу. цАМФ-независимый гликогенолиз также активируется действием вазопрессина, окситоцина и ангиотенизан II, также как через кальций или фосфатидилинозитол бифосфатный путь.
Роль гормонов в регуляции гликогенолиза и гликогенезе
Несколько факторов определяют скорость и количество расщепленного и ресинтезируемого гликогена. Во время физических упражнений внутримышечный гликоген обеспечивает основной углеводный источник энергии для работающей мышцы. Дополнительно, печеночный гликоген быстро распадается до глюкозы и высвобождается в кровь, как внемышечный источник глюкозы для снабжения энергией во время нагрузки. Снижение печеночного и мышечного гликогена в результате пищевых ограничений углеводов или интенсивной физической нагрузки, стимулирует синтез глюкозы. Это происход через глюконеогенные метаболические пути из структурных компонентов других питательных веществ, особенно белков. Несколько факторов регулируют гликолиз:
1. Гормоны играют ключевую роль в регуляции печеночных и мышечных запасов гликогена, путем контроля уровня циркулирующей в крови глюкозы. Поступление глюкозы в клетку влияет на ее последующее использование и метаболизм. Повышение уровня сахара заставляет бета-клетки поджелудочной железы секретировать дополнительный инсулин, что облегчает клетками захватывать глюкозу и останавливает дальнейшую секрецию инсулина. И, наоборот, когда уровень сахара падает в крови, альфа-клетки поджелудочной железы секретируют глюкагон. Глюкагон повышает уровень глюкозы в крови, стимулируя печеночный распад гликогена. Глюкагон называют антагонистом инсулина.
Глюкоза находится в окружающей внеклеточной жидкости для транспорта через клеточную мембрану используется семейство из 5 белков, которое называются "переносчики, облегчающие транспорт клюкозы", и стимулирется этот процесс, называемый облегченная диффузия. Мышечные волокна и адипоциты содержит инсулин-зависящие транспортеры, известные, как GluT4 или GLUT 4. Эти транспортеры, в ответ на инсулин и физическую нагрузку (независимую от инсулина) мигрируют из везикул внутри клетки в плазматическую мембрану. Их деяетльность обеспечивает транспорт глюкозы в саркоплазму, где в последствии катаболизируется до АТФ. Другой транспортер, GLUT-1, служит для транспорта глюкозы на базальном уровне.
Обмен глюкозы в мышцах по сравнению с печенью носит редуцированный характер. Ведь печень обеспечивает углеводами все органы и ткани, а мышцы работают в соответствии с принципом самообслуживания. Здесь происходит создание запаса гликогена в состоянии покоя и использование его и вновь поступающей глюкозы при работе. Запасы гликогена в мышцах не превышают 1% от их массы. Основные энергетические потребности интенсивно работающей мускулатуры удовлетворяются за счет окисления продуктов обмена жиров, а глюкоза используется здесь в гораздо меньшей степени. В процессе гликолиза из нее образуется пируват, который утилизируют скелетные мышцы. При повышении уровня работы мышечная ткань вступает в анаэробные условия, производя пируват в лактат. Тот диффундирует в печень, где используется для глюкозного ресинтеза, а также может окисляться в миокарде, который практически всегда работает в аэробных условиях.
Итак:
2. Концентрация ключевых гликолитических ферментов гексокиназа, фосфофруктокиназа и пируват киназа.
3. Уровень субстрата фруктоза-1.6-дифосфат
4. Кислород, который в избытке ингибирует гликолиз.
1. Гормоны играют ключевую роль в регуляции печеночных и мышечных запасов гликогена, путем контроля уровня циркулирующей в крови глюкозы. Поступление глюкозы в клетку влияет на ее последующее использование и метаболизм. Повышение уровня сахара заставляет бета-клетки поджелудочной железы секретировать дополнительный инсулин, что облегчает клетками захватывать глюкозу и останавливает дальнейшую секрецию инсулина. И, наоборот, когда уровень сахара падает в крови, альфа-клетки поджелудочной железы секретируют глюкагон. Глюкагон повышает уровень глюкозы в крови, стимулируя печеночный распад гликогена. Глюкагон называют антагонистом инсулина.
Глюкоза находится в окружающей внеклеточной жидкости для транспорта через клеточную мембрану используется семейство из 5 белков, которое называются "переносчики, облегчающие транспорт клюкозы", и стимулирется этот процесс, называемый облегченная диффузия. Мышечные волокна и адипоциты содержит инсулин-зависящие транспортеры, известные, как GluT4 или GLUT 4. Эти транспортеры, в ответ на инсулин и физическую нагрузку (независимую от инсулина) мигрируют из везикул внутри клетки в плазматическую мембрану. Их деяетльность обеспечивает транспорт глюкозы в саркоплазму, где в последствии катаболизируется до АТФ. Другой транспортер, GLUT-1, служит для транспорта глюкозы на базальном уровне.
Обмен глюкозы в мышцах по сравнению с печенью носит редуцированный характер. Ведь печень обеспечивает углеводами все органы и ткани, а мышцы работают в соответствии с принципом самообслуживания. Здесь происходит создание запаса гликогена в состоянии покоя и использование его и вновь поступающей глюкозы при работе. Запасы гликогена в мышцах не превышают 1% от их массы. Основные энергетические потребности интенсивно работающей мускулатуры удовлетворяются за счет окисления продуктов обмена жиров, а глюкоза используется здесь в гораздо меньшей степени. В процессе гликолиза из нее образуется пируват, который утилизируют скелетные мышцы. При повышении уровня работы мышечная ткань вступает в анаэробные условия, производя пируват в лактат. Тот диффундирует в печень, где используется для глюкозного ресинтеза, а также может окисляться в миокарде, который практически всегда работает в аэробных условиях.
Итак:
- Инсулин играет ключевую роль в регуляции углеводного метаболизма, обеспечивая поступление глюкозы в клетку, активируя ее транспорт через клеточные мембраны, ускоряя окисление. Кроме того, он стимулирует гликогенообразование, липо- и протеиногенез. Одновременно тормозится гликогенолиз, липолиз и глюконеогенез.
- Глюкагон, наоборот, активирует процессы, ведущие к росту концентрации глюкозы в крови.
- Глюкокортикостероиды действуют в направлении гипергликемии, стимулируя процессы продукции глюкозы печенью.
- Адреналин усиливает мобилизацию гликогена.
- Соматотропный гормон увеличивает секрецию и глюкагона, и инсулина, что ведет как к увеличению депонирования глюкозы, так и к усилению утилизации.
- Соматостатин тормозит продукцию соматотропина и опосредованно сдерживает выработку инсулина и глюкагона.
2. Концентрация ключевых гликолитических ферментов гексокиназа, фосфофруктокиназа и пируват киназа.
3. Уровень субстрата фруктоза-1.6-дифосфат
4. Кислород, который в избытке ингибирует гликолиз.
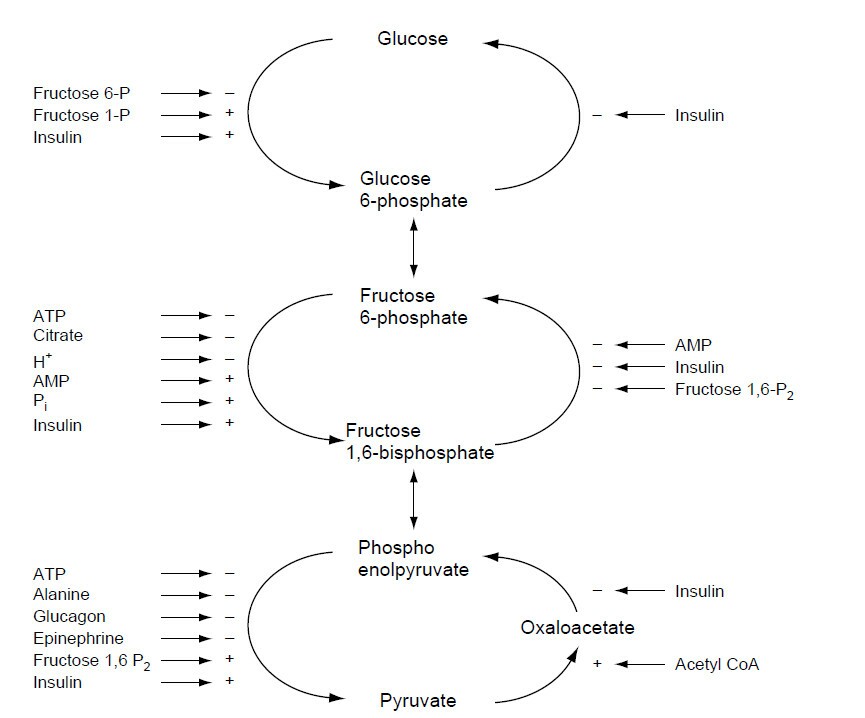
На рисунке выше точки регуляции синтеза и распада гликогена.
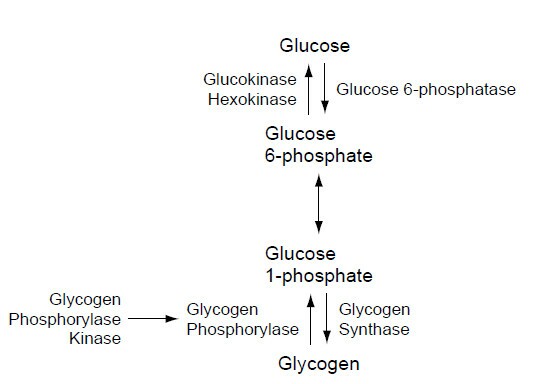
На рисунке выше регуляция гликолиза и гликонеогенеза в печени
Клинические аспекты
Болезни, связанные с накоплением гликогена (гликогенозы)
Гликогеноз - термин, общий для группы наследственных заболеваний, характеризующихся отложением в тканях либо ненормально больших количетсв гликогена, либо необычных его видов.
Гликогенез I типа (болезнь Гирке) - характеризуется заполнением клеток печени и извитых печеночных канальцев гликогеном, и эти запасы недоступны, об этом свидетельствует гипогликемия, а также отсутствие повышения глюкозы в крови в ответ на адреналин и глюкагон. В печени, почках и тканях кишечника активность глюкозо-6-фосфатазы либо крайне низка, либо вообще отсутствует.
Гликогенез II типа (болезнь Помпа) ведет к фатальным последствиям и характеризуется отсутствием лизосомальной альфа (1-4_ и (1-6)-глюкозидазы (кислой мальтазы), функцией которой является деградация гликогена, предотвращающая его накопление в лизосомах.
Гликогенез III типа (лимитдекстриноз; болезнь Форбса или болезнь Кори) характеризуется отстутствием деветвящего фермента; в результате накапливается характерный разветвленный полисахарид (остаточный декстрин).
Гликогеноз IV типа (амилопектиноз; болезнь Андерсен) характеризуется отсутствием ветвящего фермента, в результате чего накапливается полисахарид, содержащий незначительное число ветвей. Обычно летальный исход в течение первого года жизни.
Гликогеноз V типа (миофосфорилазная недостаточность; синдром Мак-Ардля) характеризуется отсутствием мышечной фосфорилазы (миофосфорилазы) - у больных пониженная выносливость к физическим нагрузкам, при высокой их концентрации в мышцах.
Гликогеноз VI типа (болезнь Герса) - недостаточность фосфорилазы печени.
Гликогеноз VII типа (болезнь Таруи) - недостаточность фосфиролазы мышц и эритроцитов.
Гликогенез I типа (болезнь Гирке) - характеризуется заполнением клеток печени и извитых печеночных канальцев гликогеном, и эти запасы недоступны, об этом свидетельствует гипогликемия, а также отсутствие повышения глюкозы в крови в ответ на адреналин и глюкагон. В печени, почках и тканях кишечника активность глюкозо-6-фосфатазы либо крайне низка, либо вообще отсутствует.
Гликогенез II типа (болезнь Помпа) ведет к фатальным последствиям и характеризуется отсутствием лизосомальной альфа (1-4_ и (1-6)-глюкозидазы (кислой мальтазы), функцией которой является деградация гликогена, предотвращающая его накопление в лизосомах.
Гликогенез III типа (лимитдекстриноз; болезнь Форбса или болезнь Кори) характеризуется отстутствием деветвящего фермента; в результате накапливается характерный разветвленный полисахарид (остаточный декстрин).
Гликогеноз IV типа (амилопектиноз; болезнь Андерсен) характеризуется отсутствием ветвящего фермента, в результате чего накапливается полисахарид, содержащий незначительное число ветвей. Обычно летальный исход в течение первого года жизни.
Гликогеноз V типа (миофосфорилазная недостаточность; синдром Мак-Ардля) характеризуется отсутствием мышечной фосфорилазы (миофосфорилазы) - у больных пониженная выносливость к физическим нагрузкам, при высокой их концентрации в мышцах.
Гликогеноз VI типа (болезнь Герса) - недостаточность фосфорилазы печени.
Гликогеноз VII типа (болезнь Таруи) - недостаточность фосфиролазы мышц и эритроцитов.
Количество углеводов, рекомендуемое для приёма.
Зерна, печенье, конфеты, хлеб, выпечка являются богатым источником углеводов. Фрукты менее ценны как источник углеводов из-за их большого содержания воды. Однако, высушенная порция этого продукта, продаваемая как деградированная, является почти чистым углеводов.
Для среднестатистического человека, весом 70 кг, ежедневный прием углеводов составляет почти 300 грамм или 40-50% общей калорийности пищевого рациона. Для более физически активных лиц и тех, кто занимается спортом, углеводы должны достигать 60% калорийности ежедневного рациона или 400-600 грамм, в основном в форме нерафинированных, богатых клетчаткой фруктов, зерен и овощей. В период интенсивных физических нагрузок, рекомендуется увеличить прием углеводов на 70% от общегоколичества потребляемых калорий (8-10 г на кг массы тела).
Потребность в углеводах для девушек составляет в среднем 360 г, для юношей - 400 г в сутки. Минимальное количество углеводов в пищевом рационе не должно быть ниже 50-60 г. Дальнейшее снижение количества углеводов ведет к нарушению обменных процессов в организме, в том числе к использованию в качестве энергетического материала тканевых белков (в первую очередь мышечных).
Пищевыми диетическими источниками углеводов являются фрукты, зерна и овощи, которые не для всех лиц являются типичным. Средний горожанин потребляет 50% углеводов в качестве простых сахаров, которые приходят в основном из сахара процессированных продуктов, такие как сахароза, богатый фруктозой кукурузный сироп. Эти сахара не приходят из фруктов и овощей, богатых питательными веществами и простыми сахарами.
На долю сложных сложных углеводов (крахмал, гликоген) должно приходиться 80-90% от общего количества потребляемых углеводов, т.е. в среднем 300-400 г в сутки для взрослых здоровых людей, 290-360 г – для подростков. Доля рафинированных легкоусвояемых углеводов (сахаров) должна составлять не более 50-100 г в сутки.
Американские диетологи рекомендуют следующее:
Для среднестатистического человека, весом 70 кг, ежедневный прием углеводов составляет почти 300 грамм или 40-50% общей калорийности пищевого рациона. Для более физически активных лиц и тех, кто занимается спортом, углеводы должны достигать 60% калорийности ежедневного рациона или 400-600 грамм, в основном в форме нерафинированных, богатых клетчаткой фруктов, зерен и овощей. В период интенсивных физических нагрузок, рекомендуется увеличить прием углеводов на 70% от общегоколичества потребляемых калорий (8-10 г на кг массы тела).
Потребность в углеводах для девушек составляет в среднем 360 г, для юношей - 400 г в сутки. Минимальное количество углеводов в пищевом рационе не должно быть ниже 50-60 г. Дальнейшее снижение количества углеводов ведет к нарушению обменных процессов в организме, в том числе к использованию в качестве энергетического материала тканевых белков (в первую очередь мышечных).
Пищевыми диетическими источниками углеводов являются фрукты, зерна и овощи, которые не для всех лиц являются типичным. Средний горожанин потребляет 50% углеводов в качестве простых сахаров, которые приходят в основном из сахара процессированных продуктов, такие как сахароза, богатый фруктозой кукурузный сироп. Эти сахара не приходят из фруктов и овощей, богатых питательными веществами и простыми сахарами.
На долю сложных сложных углеводов (крахмал, гликоген) должно приходиться 80-90% от общего количества потребляемых углеводов, т.е. в среднем 300-400 г в сутки для взрослых здоровых людей, 290-360 г – для подростков. Доля рафинированных легкоусвояемых углеводов (сахаров) должна составлять не более 50-100 г в сутки.
Американские диетологи рекомендуют следующее:
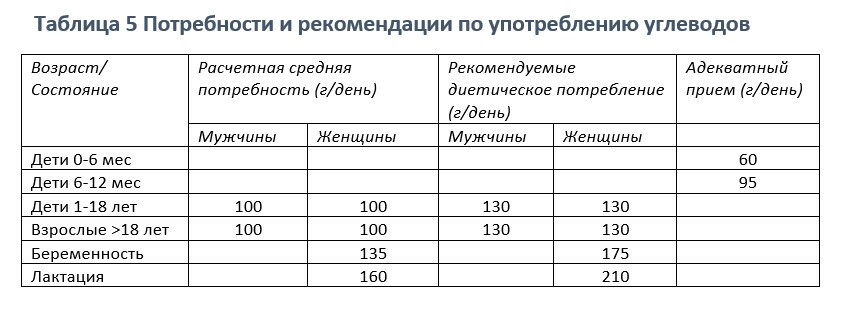
В России, на настоящее время следующие рекомендации
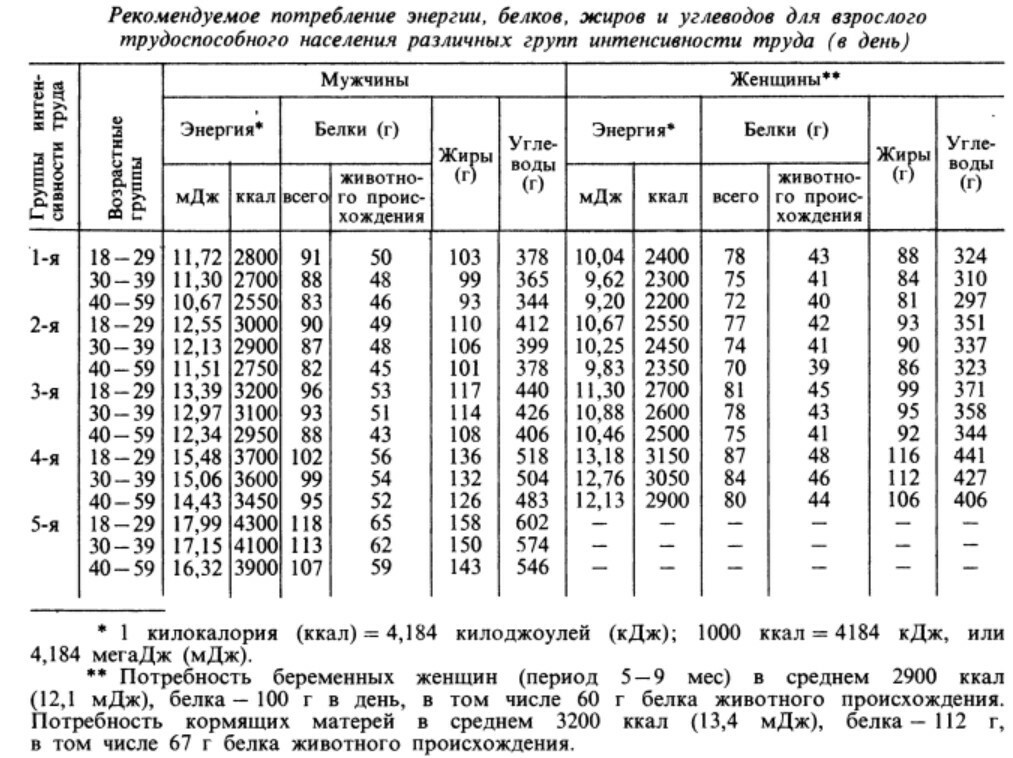


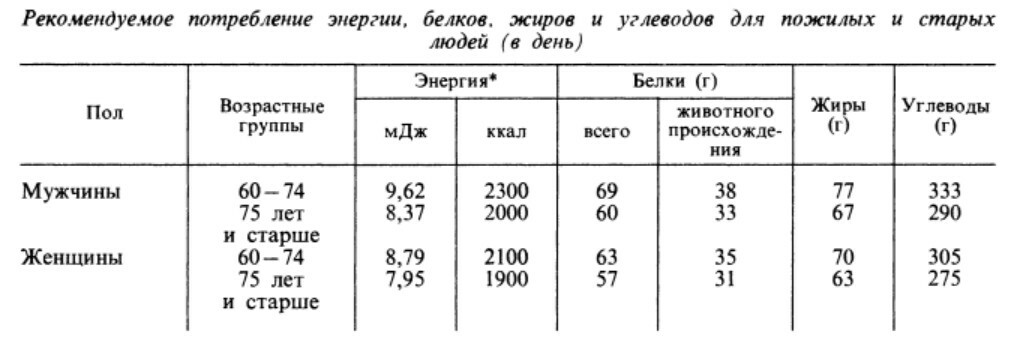
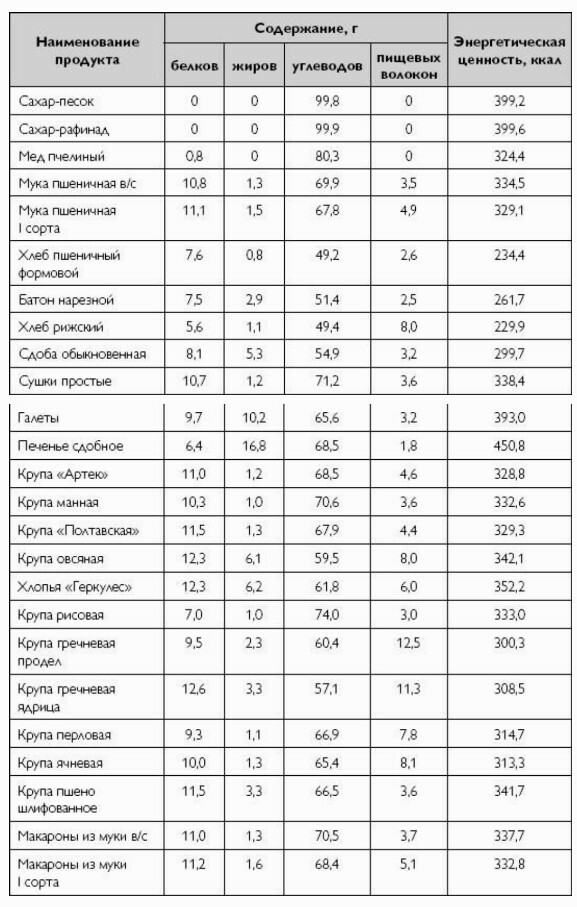
Роль углеводов в организме
Углеводы выполняют четыре важные функции, связанные с энергетическим метаболизмом и физической нагрузкой.
Источник энергии
Углеводы в основном служат источником энергии, особенно в период высокоинтенсивных физических нагрузок. Энергия получаемая из катаболизма глюкозы крови и мышечного гликогена, расходуется на сокращение мышечных волокон и другие формы биологической работы.
Достаточное ежедневное употребление углеводов для физически активных лиц поддерживает относительно ограниченные запасы гликогена. Однако, как только клетки достигают их максимальных возможностей накопления гликогена, избыток сахаров конвертируется в запасы жира. Конверсия макронутриентов в качестве источников энергии объясняет, каким образом увеличивается количество жира теле, когда количество принимаемых в пищу углеводов превосходят потребности в энергии, даже если диета содержит малое количество жиров.
Достаточное ежедневное употребление углеводов для физически активных лиц поддерживает относительно ограниченные запасы гликогена. Однако, как только клетки достигают их максимальных возможностей накопления гликогена, избыток сахаров конвертируется в запасы жира. Конверсия макронутриентов в качестве источников энергии объясняет, каким образом увеличивается количество жира теле, когда количество принимаемых в пищу углеводов превосходят потребности в энергии, даже если диета содержит малое количество жиров.
Сохранитель белка
Адекватное количество принимаемых углеводов помогает сохранить тканевой протеин. В норме белок играет жизненно важную роль в структуре, восстановлении и росте тканей, и в значительно меньшей степени служит источником энергии. Истощение резерва гликогена – легко возникающее при голодании, пониженном поступлении энергии и/или приеме углеводов и интенсивных нагрузках – резко влияет на источник топлива для энергии. Дополнительно к стимуляции жирового катаболизма, дефицит гликогена становится триггером для синтеза глюкозы из лабильного пула аминокислот (белков). Эта глюконеогенная конверсия предлагает метаболические варианты увеличения доступности углеводов (и поддержания плазматического уровня глюкозы) даже при несостоятельности гликогенных запасов. Цена за это, тем не менее, напрягает уровни протеина в организме. В крайнем случае, это уменьшает массу нежировой ткани и добавляет нагрузку на почки, заставляя их выделять азотные продукты распада белков.
Вот почему рекомендуется адекватное потребление углеводов, а не избытка белков, для увеличения мышечной массы, через тренировки с силовым напряжением.
Вот почему рекомендуется адекватное потребление углеводов, а не избытка белков, для увеличения мышечной массы, через тренировки с силовым напряжением.
Метаболический праймер / Защитник от кетоза
Компоненты распада углеводов служат «праймерами», субстратами для жирового окисления. Недостаточный распад углеводов – либо из-за ограничения транспорта глюкозы внутрь клетки (например, при диабете, когда снижается продукция инсулина или возрастает резистентность к инсулину) или распада гликогена из-за неадекватной диеты или длительной физической нагрузки – вызывает мобилизацию жира для повышенного окисления жиров. Недостаточное количество продуктов катаболизма гликогена приводит к неполному расщеплению жира с накоплением кетоновых тел (ацетоацетата и бета-гидроксибутирата, ацетоноподобных продукты неполного распада жиров). При повышении кетоновых тел повышается кислотность жидкостей организма, что вызывает потенциально опасное состояние, называемое ацидозом или, в частности, в отношении метаболизма жиров, кетозом.
Топливо для центральной нервной системы
Центральная нервная система требует непрерывного потока углеводов для нормального функционирования. При нормальных состояниях, мозг метаболизирует глюкозу крови почти эксклюзивно в качестве своего источника энергии. При плохо регулируемом диабете, во время голодовки или длительной низкоуглеводной диете, мозг адапитируется около 8 дней и начинает метаболизировать большее количество жира (как кетоны) для получения энергии. Хронические низкоуглеводные, высокожировые диеты также индуцируют адаптацию в скелетной мускулатуре, что повышает использование жиров при низко-умеренных физических нагрузках, и таким образом сохраняет мышечный гликоген.
Сахар крови обычно остается регулируемым в пределах узкого коридора по двум причинам:
Сахар крови обычно остается регулируемым в пределах узкого коридора по двум причинам:
- Глюкоза служит основным источником энергии для нервной системы;
- Глюкоза представляет собой единственный источник энергии для эритроцитов.
Пластическая функция
Пластическая функция углеводов заключается в их участии в синтезе гликопротеинов и гликолипидов, а также возможности выступать предшественниками триглицеридов, заменимых аминокислот, использоваться при построении многих других биологически значимых соединений.
Динамика углеводов при физических упражнениях.
Два фактора, интенсивность и длительность усилий, а также тренированность и состояние питания выполняющего упражнения, определяют источники энергии во время упражнений.
Печень увеличивает высвобождение глюкозы для работающей мускулатуры при прогрессировании нагрузки от низкой к интенсивной. Одновременно, мышечный гликоген является источником углеводной энергии на ранних стадиях упражнений и при увеличении интенсивности. В сравнении с жирами и белками, углеводы остаются приоритетным топливом при интенсивной аэробной нагрузке, так как они быстро поставляют энергию (АТФ) через окислительные процессы. Во время анаэробных упражнений, углеводы превращаются в единственное доступное топливо ресинтеза АТФ. Только 3 дня диеты, содержащей 5% углеводов, тотально снижают все типы физической деятельности.
Доступность углеводов в метаболической смеси контролирует ее использование для энергии. В свою очередь, прием углеводов в рационе существенно влияет на их доступность. Концентрация углеводов в крови обеспечивает обратную регуляцию выхода глюкозы из печени – повышение уровня глюкозы в крови ингибирует высвобождение печеночной глюкозы во время упражнений. Доступность углеводов во время упражнения позволяет регулировать мобилизацию жиров и их использование для энергии. Например, увеличение окисления углеводов, путем употребления в пищу перед тренировкой углеводов (сопровождающих гипергликемией и гиперинсулинемией) ингибирует два процесса:
1) окисление длинноцепочных жирных кислот мышечной тканью;
2) высвобождение свободных жирных кислот из жировой ткани. Адекватная доступность углеводов (и как результат увеличенный катаболизм) может также ингибировать транспорт длинноцепочных жирных кислот в митохондрии, выполняя таким образом метаболическую смесь для выполняемых упражнений.
Печень увеличивает высвобождение глюкозы для работающей мускулатуры при прогрессировании нагрузки от низкой к интенсивной. Одновременно, мышечный гликоген является источником углеводной энергии на ранних стадиях упражнений и при увеличении интенсивности. В сравнении с жирами и белками, углеводы остаются приоритетным топливом при интенсивной аэробной нагрузке, так как они быстро поставляют энергию (АТФ) через окислительные процессы. Во время анаэробных упражнений, углеводы превращаются в единственное доступное топливо ресинтеза АТФ. Только 3 дня диеты, содержащей 5% углеводов, тотально снижают все типы физической деятельности.
Доступность углеводов в метаболической смеси контролирует ее использование для энергии. В свою очередь, прием углеводов в рационе существенно влияет на их доступность. Концентрация углеводов в крови обеспечивает обратную регуляцию выхода глюкозы из печени – повышение уровня глюкозы в крови ингибирует высвобождение печеночной глюкозы во время упражнений. Доступность углеводов во время упражнения позволяет регулировать мобилизацию жиров и их использование для энергии. Например, увеличение окисления углеводов, путем употребления в пищу перед тренировкой углеводов (сопровождающих гипергликемией и гиперинсулинемией) ингибирует два процесса:
1) окисление длинноцепочных жирных кислот мышечной тканью;
2) высвобождение свободных жирных кислот из жировой ткани. Адекватная доступность углеводов (и как результат увеличенный катаболизм) может также ингибировать транспорт длинноцепочных жирных кислот в митохондрии, выполняя таким образом метаболическую смесь для выполняемых упражнений.
Высокоинтенсивная нагрузка
Нейрогуморальные факторы во время интенсивных физических нагрузок увеличивают выход адреналина, норадреналина и глюкагона, снижают высвобождение инсулина. Этот гормональный ответ активирует гликоген-фосфорилазу (не напрямую, а через активацию цАМФ), этот фермент обеспечивает гликогенолиз в печени и работающей мышечной ткани. Так как мышечный гликоген обеспечивает поставки энергии без участия кислорода, он вносит значительный энергетический вклад в первые минуты упражнений, когда поступление кислорода не соответствует его потребностям. По мере продолжения нагрузки, глюкоза крови увеличивает свой вклад, как источник энергии. Например, сахар крови может обеспечивать до 30% общей энергетической потребности во время очень интенсивной мышечной работы, с сохраняющейся углеводной подпиткой через мышечный гликоген.
Один час высокоинтенсивной нагрузки снижает уровень печеного гликогена на 55%, а 2 часа напряженной работы почти полностью истощают гликоген в печени и работающей мускулатуре.
Рисунок ниже демонстрирует, что мышечное потребление циркулирующей глюкозы резко возрастает после начальной фазы циклических упражнений и продолжает увеличиваться по мере продолжения нагрузки. После 40 минут, захват кислорода возрастает с 7 до 20 кратного увеличения от уровня покоя, и зависит от интенсивности нагрузки. Преимущество селективной зависимости от метаболизма углеводов во время интенсивной аэробной нагрузки происходит от скорости получения энергии, которая дважды выше, чем от жиров или протеинов. В дополнение, углеводы производят на 6% больше энергии, чем жиры на литр потребленного кислорода.
Один час высокоинтенсивной нагрузки снижает уровень печеного гликогена на 55%, а 2 часа напряженной работы почти полностью истощают гликоген в печени и работающей мускулатуре.
Рисунок ниже демонстрирует, что мышечное потребление циркулирующей глюкозы резко возрастает после начальной фазы циклических упражнений и продолжает увеличиваться по мере продолжения нагрузки. После 40 минут, захват кислорода возрастает с 7 до 20 кратного увеличения от уровня покоя, и зависит от интенсивности нагрузки. Преимущество селективной зависимости от метаболизма углеводов во время интенсивной аэробной нагрузки происходит от скорости получения энергии, которая дважды выше, чем от жиров или протеинов. В дополнение, углеводы производят на 6% больше энергии, чем жиры на литр потребленного кислорода.
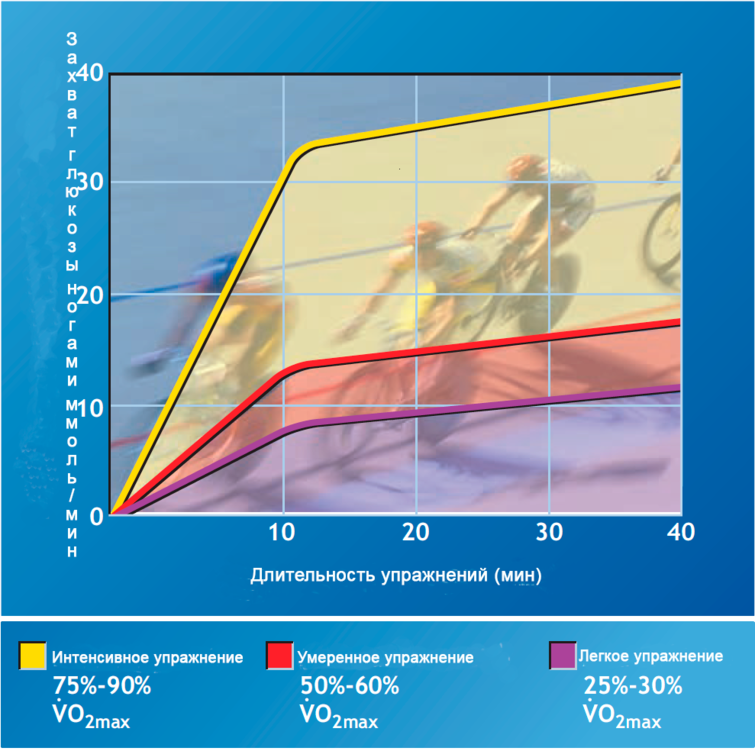
Умеренная и длительная нагрузка
Гликоген, запасенный в активной мускулатуре, обеспечивает почти всю потребность в энергии от покоя до умеренной нагрузки. Во время следующих 20 минут, печень и мышечный гликоген дают от 40 до 50% необходимой энергии, остальное обеспечивает катаболизм жиров и ограниченное количество белков. По сути, смесь источников энергии зависит от относительной интенсивности нагрузки. Во время низкоинтенсивной нагрузки, жиры служат основным субстратом энергии. По мере продолжения нагрузки и снижения уровня мышечного гликогена, глюкоза крови становится главным источником углеводной энергии, тогда как катаболизм жиров обеспечивает постепенно увеличивающийся процент общей энергии. В итоге, выход печеночной глюкозы не справляется с потреблением глюкозы мышцами, и уровень плазматической глюкозы снижается. В таких случаях, глюкоза крови может достигать гипогликемического уровня.
Рисунок ниже описывает метаболический профиль во время пролонгированной нагрузке в условиях глюкозной нагрузки и глюкозной недостаточности. При прогрессировании субмаксимальной нагрузки при гликоген-обедненном состоянии, уровень глюкозы падает, а циркулирующих жиров (в основном в форме свободных жирных кислоты, СЖК, FFA) резко увеличивается, в сравнении с упражнениями при гликоген-нагруженных состояниях. Одновременно, вклад белков в энергетический расход растет. Интенсивность нагрузки (выраженная в процентах от максимума) также прогрессивно снижается при гликоген-обедненных состояниях. К концу 2-го часа, выполняющий нагрузку может поддерживать только около 50% от начальной интенсивности упражнения. Снижение мощности работы происходит из-за относительно медленного аэробного высвобождения энергии от окисления жиров, который теперь становится главным источником энергии. Любой из следующих семи ограничивающих скорость потенциальных метаболических процессов, которые предшествуют циклу Кребса могут объяснить относительно медленную скорость окисления жиров, по сравнению с углеводами:
Усталость приходит во время упражнения в тот момент, когда возникает компромисс между гликогеном печени и мускулатуры и почти неограниченным источником энергии из жира. Выносливые атлеты обычно приходят к этому состоянию и называют его «убиться об стену». Так как скелетная мускулатура начинает испытывать недостаток фосфатазы, позволяющей обмениваться глюкозой между клетками, а относительно неактивные мышцы, между тем, сохраняют свой полный запас гликогена. Остается непонятно, почему истощение мышечного гликогена совпадет с точкой усталости. Ответ может иметь отношение к следующим трем факторам:
Рисунок ниже описывает метаболический профиль во время пролонгированной нагрузке в условиях глюкозной нагрузки и глюкозной недостаточности. При прогрессировании субмаксимальной нагрузки при гликоген-обедненном состоянии, уровень глюкозы падает, а циркулирующих жиров (в основном в форме свободных жирных кислоты, СЖК, FFA) резко увеличивается, в сравнении с упражнениями при гликоген-нагруженных состояниях. Одновременно, вклад белков в энергетический расход растет. Интенсивность нагрузки (выраженная в процентах от максимума) также прогрессивно снижается при гликоген-обедненных состояниях. К концу 2-го часа, выполняющий нагрузку может поддерживать только около 50% от начальной интенсивности упражнения. Снижение мощности работы происходит из-за относительно медленного аэробного высвобождения энергии от окисления жиров, который теперь становится главным источником энергии. Любой из следующих семи ограничивающих скорость потенциальных метаболических процессов, которые предшествуют циклу Кребса могут объяснить относительно медленную скорость окисления жиров, по сравнению с углеводами:
- Мобилизация СЖК из жировой ткани;
- Транспорт СЖК в скелетную мускулатуру через кровоток;
- Захват СЖК мышечной клеткой;
- Захват СЖК мышечной клеткой из триглициридов в хиломикронах и липопротеинов;
- Мобилизация жирных кислоты из внутримышечных триглицеридов и цитоплазматический транспорт;
- Транспорт жирных кислот в митохондрии;
- Окисление жирных кислот в митохондриях.
Усталость приходит во время упражнения в тот момент, когда возникает компромисс между гликогеном печени и мускулатуры и почти неограниченным источником энергии из жира. Выносливые атлеты обычно приходят к этому состоянию и называют его «убиться об стену». Так как скелетная мускулатура начинает испытывать недостаток фосфатазы, позволяющей обмениваться глюкозой между клетками, а относительно неактивные мышцы, между тем, сохраняют свой полный запас гликогена. Остается непонятно, почему истощение мышечного гликогена совпадет с точкой усталости. Ответ может иметь отношение к следующим трем факторам:
- Пониженная доступность глюкозы крови для оптимального функционирования нервной системы;
- Роль мышечного гликогена в качестве праймера при распаде жиров;
- Низкая скорость высвобождения по сравнению с распадом углеводов.
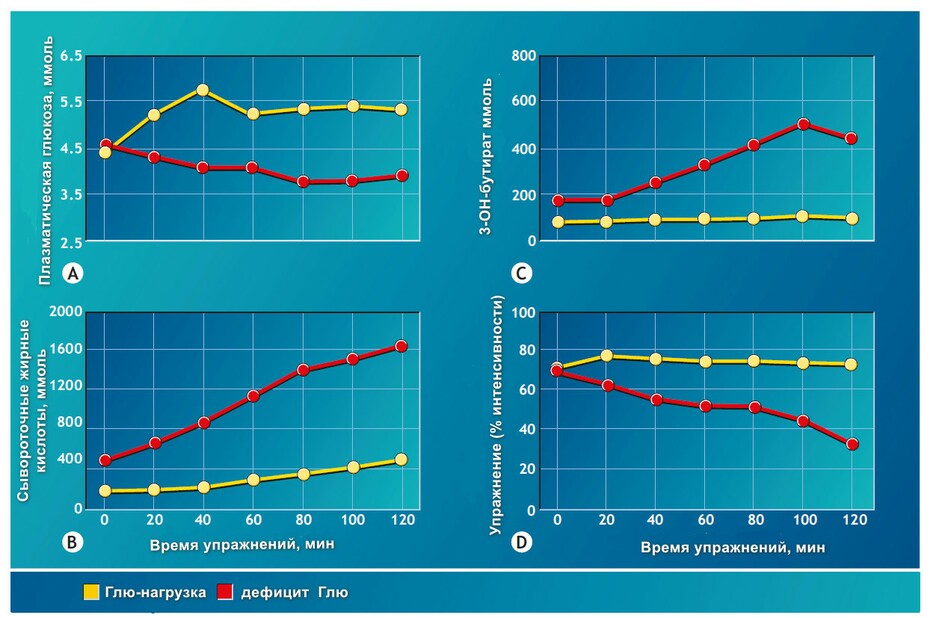
Эффект диеты на запасы гликогена в мышечной ткани и выносливость
Пищевой состав существенно влияет на запасы гликогена и выполнение последующих физических упражнений. В классическом эксперименте, иллюстрированном на рисунке ниже шесть человек придерживались диеты, с нормальным калорийным содержанием, но большая часть их калорий была представлена липидами и 5% или меньше углеводами (высокожировая диета). Во втором состоянии (нормальная диета) – 3-х дневная диета содержала рекомендуемый процентный состав белков, жиров и углеводов, третья диета была представлена 82% источником калорий в форме углеводов (высокоуглеводная диета). Содержание гликогена оценивали путем биопсии четырехглавой мышцы бедра, и было 0,63 г на 100 г влажной мышечной ткани при высокожировой диете, 1,75 г при нормальной диете и 3,75 г при высокоуглеводной диете.
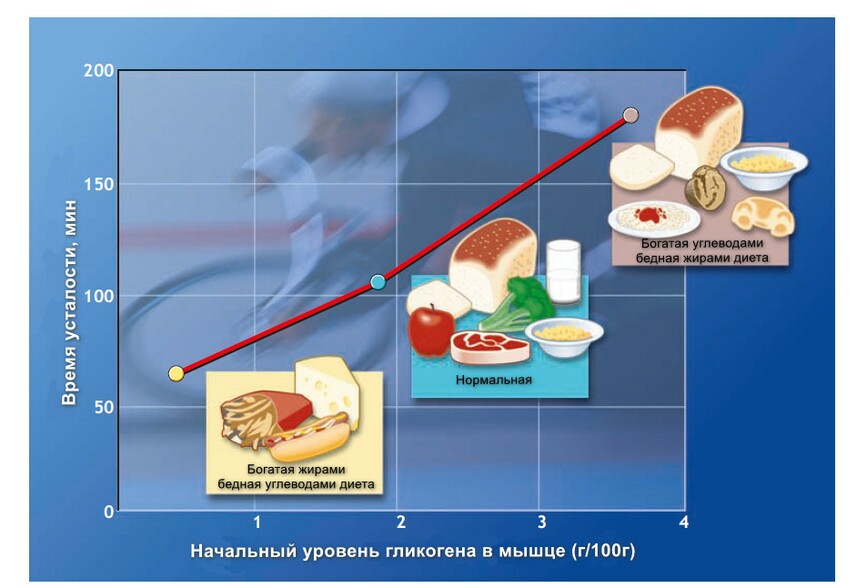
Выносливость во время циклических упражнений варьировала значительно, в зависимости от формы диеты за 3 дня до теста. При нормальной диете, упражнение длилось 114 минут, тогда как выносливость для высокожировой диеты была только 57 минут. Высокоуглеводная диета улучшила выносливость более, чем в три раза по сравнению с высокожировой диетой.
Углеводнодефицитная диета резко снижает запасы мышечного и печеночного гликогена и отрицательно сказывается на выполнении кратковременной анаэробной нагрузки и пролонгированной интенсивной аэробной деятельности. Интересно, что точка усталости при одинаково низком уровне мышечного гликогена была при трех диетах совпадала. Эти исследования показывают важность мышечного гликогена в поддержании высокоинтенсивных упражнений длящихся более, чем 1 час.
Диета, дефицитная углеводами резко истощает запасы гликогена в печени и мышцы и отрицательно влияет на выполнение кратковременных анаэробных упражнений и пролонгированной аэробной активности.
Углеводнодефицитная диета резко снижает запасы мышечного и печеночного гликогена и отрицательно сказывается на выполнении кратковременной анаэробной нагрузки и пролонгированной интенсивной аэробной деятельности. Интересно, что точка усталости при одинаково низком уровне мышечного гликогена была при трех диетах совпадала. Эти исследования показывают важность мышечного гликогена в поддержании высокоинтенсивных упражнений длящихся более, чем 1 час.
Диета, дефицитная углеводами резко истощает запасы гликогена в печени и мышцы и отрицательно влияет на выполнение кратковременных анаэробных упражнений и пролонгированной аэробной активности.
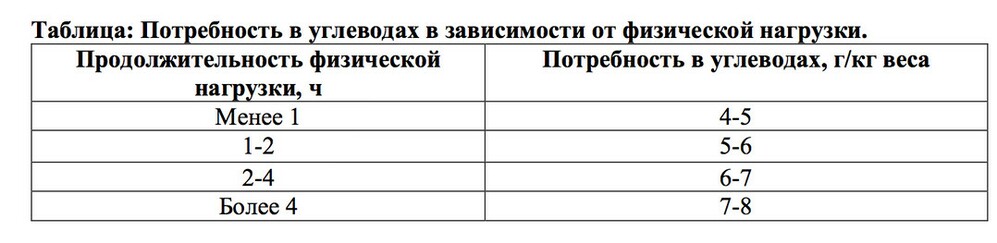
Обновление 17.07.2022



